题目内容
20.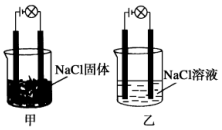 某化学兴趣小组在实验室中进行化学实验,按如图甲连接好线路发现灯泡不亮,按图乙连接好线路发现灯泡亮,由此得出的结论正确的是
某化学兴趣小组在实验室中进行化学实验,按如图甲连接好线路发现灯泡不亮,按图乙连接好线路发现灯泡亮,由此得出的结论正确的是( )
| A. | NaCl溶液是电解质 | |
| B. | 在通电的条件下,NaCl在水中电离出大量的离子而导电 | |
| C. | NaCl固体中无阴阳离子,因此不能导电 | |
| D. | 同一温度下,将乙中NaCl溶液换成等浓度的MgCl2溶液,溶液导电性增强 |
分析 在水溶液里或熔融状态下能导电的化合物是电解质,在水溶液和熔融状态下都不导电的化合物是非电解质,含有自由移动的离子或电子的物质能导电,据此分析解答.
解答 解:A.氯化钠溶液含有自由移动的离子,所以能导电,但NaCl溶液是混合物,既不是电解质也不是非电解质,故A错误;
B.NaCl在水溶液中在水的作用下电离出了可以自由移动的离子,不是在通电时才电离,故B错误;
C.NaCl晶体中存在阴阳离子,但是阴阳离子不能自由移动,所以不导电,故C错误;
D.同一温度下,将乙中NaCl溶液换成等浓度的MgCl2溶液,溶液中电荷的浓度增大,所以溶液导电性增强,故D正确;
故选D.
点评 本题考查溶液导电实质、电解质概念分析判断,掌握基础是关键,题目较简单,侧重于考查学生对知识的迁移应用能力.

练习册系列答案
相关题目
10.NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | C2H4和C3H6的混合物的质量为a g,所含碳氢键数目为aNA/7 | |
| B. | 1.0 L 1.0 mol•L-1的NaAlO2水溶液中含有的氧原子数为2NA | |
| C. | 25℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| D. | 1 mol的羟基与1 mol的氢氧根离子所含电子数均为9NA |
11.现有20.0g某铁矿石样品(主要成分为Fe2O3和FeO).粉碎后加入足量盐酸(假设杂质不与盐酸反应),充分反应后过滤,向滤液中加入足量氢氧化钠溶液,过滤,将所得沉淀在空气中蒸干并灼烧,冷却后称得固体质量为16.0g,则该铁矿石样品中铁元素的质量分数为( )
| A. | 28% | B. | 56% | C. | 72% | D. | 80% |
8.短周期元素A、B、C的原子序数依次增大,其原子的最外层电子数之和为10,且A与C在周期表中位置上下相邻,B原子最外层电子数等于A原子次外层电子数,下列有关叙述不正确的是( )
| A. | 原子半径:A<B<C | |
| B. | A的氢化物的稳定性大于C的氢化物的稳定性 | |
| C. | A的最高价氧化物与B的单质可以发生置换反应 | |
| D. | C的氧化物的熔点比A的氧化物熔点低 |
15.下列装置所示的实验中,能达到目的是( )
| A. |  长时间看到Fe(OH)2白色沉淀 | B. |  除去Cl2中的HCl杂质 | ||
| C. |  比较NaHCO3、Na2CO3的热稳定性 | D. |  分离碘酒中的碘和酒精 |
5.下列化合物中,能通过单质与酸反应或单质间化合直接制取的是( )
| A. | CuCl2 | B. | FeCl2 | C. | AlCl3 | D. | FeCl3 |
12.分子式为C5H8O2的有机物,能使溴水褪色,也能与饱和NaHCO3溶液反应,则该有机物的结构(不考虑立体异构)有( )
| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
9.下列关于热化学反应的描述中正确的是( )
| A. | HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol | |
| B. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+566.0kJ/mol | |
| C. | 铁粉与硫粉需要加热才能发生的反应,则此反应是吸热反应 | |
| D. | 1mol甲烷燃烧生成水和二氧化碳所放出的热量就是甲烷燃烧热 |
5. 室温下,用0.100mol/L NaOH 溶液分别滴定20.00mL 0.100mol/L的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )
室温下,用0.100mol/L NaOH 溶液分别滴定20.00mL 0.100mol/L的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )
 室温下,用0.100mol/L NaOH 溶液分别滴定20.00mL 0.100mol/L的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )
室温下,用0.100mol/L NaOH 溶液分别滴定20.00mL 0.100mol/L的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( )| A. | Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线 | |
| B. | pH=7时,两种酸所用NaOH溶液的体积相等 | |
| C. | V(NaOH)=10.00 mL 时$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COO)}$>1 | |
| D. | V(NaOH)=20.00 mL 时,c(Cl-)<c(CH3COO-) |