题目内容
13.为了提高煤的利用率,人们先把煤转化为CO和H2,再将它们转化为甲醇,某实验人员在一定温度下的密闭容器中,充入一定量的H2和CO,发生反应:2H2(g)+CO(g)$\stackrel{催化}{→}$CH3OH(g),测定的部分实验数据如下:| t/s | 0 | 500s | 1 000s |
| c(H2)/(mol•L-1) | 5.00 | 3.52 | 2.48 |
| c(CO)/(mol•L-1) | 2.50 |
(2)在1 000 s内用CO表示的化学反应速率是0.00126mol•L-1•s-1,1 000s时H2的转化率是50.4%.
(3)在500s时生成的甲醇的浓度是0.74mol•L-1.
分析 (1)结合v=$\frac{△c}{△t}$计算500s内用H2表示的化学反应速率;
(2)结合v=$\frac{△c}{△t}$计算1000s内用H2表示的化学反应速率,结合速率之比等于化学计量数之比计算1 000 s内用CO表示的化学反应速率,1000s时氢气转化5.00mol/L-2.48mol/
L=2.52mol/L,结合反应可知,转化的CO为2.52mol/L×$\frac{1}{2}$=1.26moo/L,以此计算转化率;
(3)500s时转化的氢气为5.00mol/L-3.52mol/L=1.48mol/L,结合反应计算生成的甲醇的浓度.
解答 解:(1)500s内用H2表示的化学反应速率为$\frac{1.48mol/L}{500s}$=0.00296mol•L-1•s-1,故答案为:0.00296;
(2)1000s内用H2表示的化学反应速率为$\frac{2.52mol/L}{1000s}$=0.00252mol•L-1•s-1,由速率之比等于化学计量数之比可知1 000 s内用CO表示的化学反应速率为0.00252mol•L-1•s-1×$\frac{1}{2}$=0.00126mol•L-1•s-1,1000s时氢气转化5.00mol/L-2.48mol/L=2.52mol/L,结合反应可知,转化的CO为2.52mol/L×$\frac{1}{2}$=1.26mol/L,CO的转化率为$\frac{1.26mol/L}{2.50mol/L}$×100%=50.4%,故答案为:0.00126;50.4%;
(3)500s时转化的氢气为5.00mol/L-3.52mol/L=1.48mol/L,由2H2(g)+CO(g)$\stackrel{催化}{→}$CH3OH(g)可知生成的甲醇的浓度为1.48mol/L×$\frac{1}{2}$=0.74mol/L,
故答案为:0.74.
点评 本题考查化学平衡的计算,为高频考点,把握表格中数据、速率及浓度的计算为解答的关键,侧重分析与计算能力的考查,注意数据分析的应用,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 70℃,将0.1mol 镁粉加入到10mL6mol•L-1的硝酸溶液中 | |
| B. | 60℃,将0.2mol 镁粉加入到20mL3mol•L-1的盐酸溶液中 | |
| C. | 60℃,将0.1mol 镁粉加入到10mL3mol•L-1的硫酸溶液中 | |
| D. | 60℃,将0.2mol 铁粉加入到10mL3mol•L-1的盐酸溶液中 |
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡时体系能量的变化 | ||
| A | B | C | ||
| ① | 2 | 1 | 0 | 0.75Q kJ |
| ② | 0.4 | 0.2 | 1.6 | |
| A. | 容器①、②中反应的平衡常数均为36 | |
| B. | 容器②中反应达到平衡时放出的热量为0.05QkJ 达到平衡时,两个容器中Y2的物质的量浓度均为1.5 mol•L-1 | |
| C. | 向容器①中通入氦气,平衡时A的转化率不变 | |
| D. | 其他条件不变,若容器②保持恒容绝热,则达到平衡时C的体积分数小于$\frac{2}{3}$ |
I、已知2NO(g)+O2(g)═2NO2(g)△H=b kJ•mol-1;CO的燃烧热△H=c kJ•mol-1.写出消除汽车尾气中NO2的污染时,NO2与CO反应的热化学方程式2NO2(g)+4CO(g)=N2(g)+4CO2(g)△H=a-b+2c kJ•mol-1.
II、一定条件下,在一密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol•L-1 | 1.00 | 0.8 | 0.64 | 0.55 | 0.5 | 0.5 |
| c(CO)/mol•L-1 | 3.50 | 3.30 | 3.14 | 3.05 | 3.00 | 3.00 |

(2)前2s内的平均反应速率υ(N2)=0.09mol/(L•s)(保留两位小数,下同);此温度下,该反应的平衡常数为0.03mol•L-1.
(3)采用低温臭氧氧化脱硫脱硝技术,同时吸收SO2和NOx,获得(NH4)2SO4的稀溶液,
①常温条件下,此溶液的PH=5,则$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$=1.7×104(已知该温度下NH3•H2O的Kb=1.7×10-5)
②向此溶液中再加入少量 (NH4)2SO4固体,$\frac{c(N{{H}_{4}}^{+})}{c(S{{O}_{4}}^{2-})}$的值将变大(填“变大”、“不变”或“变小”)
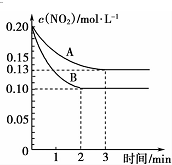
(4)设计如图1装置模拟传感器测定CO与 NO反应原理.
①铂电极为正极(填“正极”或“负极”).
②负极电极反应式为CO+O2--2e-=CO2
III、如图2所示,无摩擦、无质量的活塞1、2将反应器隔成甲、乙两部分,在25℃和101kPa下实现平衡时,各部分体积分别为V甲、V乙.此时若去掉活塞1,不引起活塞2的移动.则x=1.5,V甲:V乙=3:1.
 甲醇是重要的化工原料,又可称为燃料.工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
甲醇是重要的化工原料,又可称为燃料.工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:①CO(g)+2H2(g)═CH3OH(g)△H
②CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H2=-58kJ•mol-1
③CO2(g)+H2(g)═CO(g)+H2O(g)△H3=+41kJ•mol-1
回答下列问题:
(1)已知反应①中的相关的化学键键能数据如下:
| 化学键 | H═H | C═O | C≡O | H-O | C-H |
| F/(kJ•mol-1) | 435 | 343 | 1076 | 465 | X |
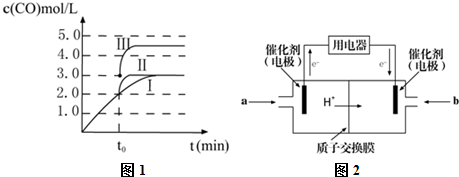
(2)若T℃时将6molCO2和8molH2充入2L密闭容器中发生反应②,测得H2的物质的量随时间变化关系如图中状态I(图中实线)所示.图中数据A(1,6)代表在1min时H2的物质的量是6mol.
①T℃时状态I条件下,0~3min内CH3OH的平均反应速率v=0.28mol/(L•min),平衡常数K=0.5;
②其他条件不变时,仅改变某一条件后测得H2的物质的量随时间变化如图中状态Ⅱ所示,则改变的条件可能是增大压强;
③其他条件不变,仅改变温度时,测得H2的物质的量随时间变化如图中状态Ⅲ所示,则状态Ⅲ对应的温度>(填“>”、“<”或“=”)T℃;
④若状态Ⅱ的平衡常数为K2,状态Ⅲ的平衡常数为K3,则K2>(填“>”、“<”或“=”)K3;
⑤一定温度下同,此反应在恒容容器中进行,能判断该反应达到化学平衡依据的是ac.
a.容器中压强不变 b.甲醇和水蒸汽的体积比保持不变
c.v正(H2)=3v逆(CH3OH) d.2个C═O断裂的同时有6个H-H断裂.
| A. | 用A表示的反应速率是0.4 mol•L-1•min-1 | |
| B. | 分别用B、C、D表示的反应速率之比是3:2:1 | |
| C. | 在2 min末的反应速率,用B表示是0.3 mol•L-1•min-1 | |
| D. | 在2 min内的反应速率,用C表示是0.3 mol•L-1•min-1 |