题目内容
8.T℃时.体积均为0.5L的两个恒容密闭容器中发生可逆反应:2A(g)+B(g)?2C(g)△H=-Q kJ/mol(Q>0)实验测得反应在起始、达到平衡时的有关数据如表:| 容器编号 | 起始时各物质物质的量/mol | 达到平衡时体系能量的变化 | ||
| A | B | C | ||
| ① | 2 | 1 | 0 | 0.75Q kJ |
| ② | 0.4 | 0.2 | 1.6 | |
| A. | 容器①、②中反应的平衡常数均为36 | |
| B. | 容器②中反应达到平衡时放出的热量为0.05QkJ 达到平衡时,两个容器中Y2的物质的量浓度均为1.5 mol•L-1 | |
| C. | 向容器①中通入氦气,平衡时A的转化率不变 | |
| D. | 其他条件不变,若容器②保持恒容绝热,则达到平衡时C的体积分数小于$\frac{2}{3}$ |
分析 容器①中参加反应的A的物质的量=2mol×$\frac{0.75QkJ}{QkJ}$=1.5mol,则:
2A(g)+B(g)?2C(g)
起始(mol):2 1 0
转化(mol):1.5 0.75 1.5
平衡(mol):0.5 0.25 1.5
恒温恒容下,②中完全转化到方程式左边可以得到2molA、1mol,容器①、②反应为完全等效平衡,平衡时各组分的物质的量相等,②中A的起始物质的量为0.4mol,小于平衡时的0.5mol,故②中发生平衡逆向移动.
A、由于温度相等,②中平衡常数与①相等;
B、.②中反应吸收热量,根据参加反应的B可以计算吸收热量;
C、恒容条件下,向容器①中通入氦气,各组分的浓度不变,平衡不移动;
D、平衡时①、②中C的体积分数为$\frac{1.5mol}{0.5mol+0.25mol+1.5mol}$=$\frac{2}{3}$其他条件不变,若容器②保持恒容绝热,随反应进行,温度降低,反应向生成C的方向移动,平衡时C的体积分数增大.
解答 解:容器①中参加反应的A的物质的量=2mol×$\frac{0.75QkJ}{QkJ}$=1.5mol,则:
2A(g)+B(g)?2C(g)
起始(mol):2 1 0
转化(mol):1.5 0.75 1.5
平衡(mol):0.5 0.25 1.5
恒温恒容下,②中完全转化到方程式左边可以得到2molA、1mol,容器①、②反应为完全等效平衡,平衡时各组分的物质的量相等,②中A的起始物质的量为0.4mol,小于平衡时的0.5mol,故②中平衡逆向移动.
A、由于温度相等,①②平衡常数相等,①中平衡常数K=$\frac{(1.5mol÷0.5L)^{2}}{(0.5mol÷0.5L)^{2}•(0.25mol÷5L)}$=18,故A错误;
B、.②中反应吸收热量,容器①、②反应为完全等效平衡,平衡时B的物质的量相等,则②中吸收的热量为(0.25-0.2)mol×Q kJ/mol=0.05Q kJ,故B错误;
C、恒容条件下,向容器①中通入氦气,各组分的浓度不变,平衡不移动,平衡时A的转化率不变,故C正确;
D、平衡时①、②中C的体积分数为$\frac{1.5mol}{0.5mol+0.25mol+1.5mol}$=$\frac{2}{3}$,其他条件不变,若容器②保持恒容绝热,随反应进行,温度降低,反应向生成C的方向移动,生成2molC时,混合气体减小1mol,则达到平衡时C的体积分数大于$\frac{2}{3}$,故D错误,
故选C.
点评 本题考查化学平衡有关计算、等效平衡、反应热等问题,为高考常见题型,侧重考查学生的分析、计算能力,题目难度中等,注意等效平衡思想的应用,关键是判断两容器内平衡途径的建立,难度中等.

| A. | 100mL0.5mol•L-1MgCl2溶液 | B. | 100mL0.5mol•L-1 HCl溶液 | ||
| C. | 200mL0.25mol•L-1 KCl溶液 | D. | 100mL0.5mol•L-1NaClO溶液 |
| A. | 醋酸亚铁 | B. | 硫酸亚铁 | C. | 氧化铁 | D. | 氯化铁 |
| A. | 氯化铵 | B. | 硫酸 | C. | 食盐 | D. | 氧化钠 |
| t/s | 0 | 500s | 1 000s |
| c(H2)/(mol•L-1) | 5.00 | 3.52 | 2.48 |
| c(CO)/(mol•L-1) | 2.50 |
(2)在1 000 s内用CO表示的化学反应速率是0.00126mol•L-1•s-1,1 000s时H2的转化率是50.4%.
(3)在500s时生成的甲醇的浓度是0.74mol•L-1.
| A. | 加入催化剂可以提高单位时间氨的产量 | |
| B. | 高压有利于氨的合成反应 | |
| C. | 500℃高温比室温更有利于合成氨的反应 | |
| D. | 恒温恒容下,在合成氨平衡体系中充入He,使压强增大,则平衡正向移动,NH3增多 |
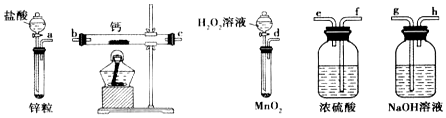

 降低大气中CO2的含量及有效地开发利用 CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
降低大气中CO2的含量及有效地开发利用 CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
 .
.