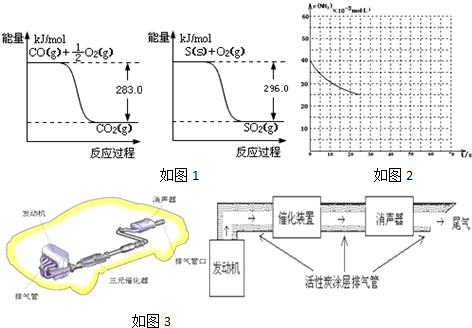
��Ŀ����
18�����������Ǵ�����Ⱦ��֮һ�����γɹ⻯ѧ����������ȣ�
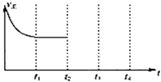
��1����һ�ܱ������з�����Ӧ2NO2��g��?2NO��g��+O2��g������Ӧ������NO2Ũ����ʱ��ı仯�����ͼ��ʾ����ش�
��������A����Ӧ��ǰ3min��������ƽ����Ӧ����Ϊ0.0175mol/��L��min����
��������A��B�ֱ��ʾ���Ǹ÷�Ӧ��ij��ͬ�����µķ�Ӧ���������������¶ȣ��Ũ�ȡ�����ѹǿ�������¶ȡ�����������
������A��B�ֱ��Ӧ�ķ�Ӧƽ�ⳣ���Ĵ�С��ϵ��KA��KB�����������������=������
��2��һ���¶��£�ij�ܱ�������N2O5�ɷ������з�Ӧ��
2N2O5��g��?4NO2��g��+O2��g�� I
2NO2��g��?2NO��g��+O2��g����
��ӦI��ƽ�ⳣ������ʽΪK=$\frac{{c}^{4}��N{O}_{2}����c��{O}_{2}��}{{c}^{2}��{N}_{2}{O}_{5}��}$������ƽ��ʱ��c�� NO2��=0.4mol•L-1��c��O2��=1.3mol•L-1����Ӧ����NO2��ת����Ϊ$\frac{6}{7}$��N2O5��g������ʼŨ��Ӧ������1.4mol•L-1��
��3����a mL NO��b mL NO2��x mLO2�����ͬһ�Թ�����Թܿڵ�����ˮ�У���ַ�Ӧ��
�Թ��������ȫ����ʧ������a��b��ʾ��xΪa
a.$\frac{��a+b��}{2}$ b.$\frac{��2a+b��}{3}$ c.$\frac{��3a+b��}{4}$ d.$\frac{��4a+b��}{5}$
��4���ü�����һ�������¿����������������Ⱦ��д��CH4����NO2�ķ�Ӧ����ʽ2NO2+CH4�TN2+CO2+2H2O��
���� ��1����������A����Ӧ��ǰ3minv��NO2��=$\frac{��0.20-0.13��mol/L}{3min}$=0.035mol/��L��min����v��O2��=$\frac{1}{2}$ v��NO2����
�ڷ�Ӧ����ƽ���ʱ�����̣�˵����ѧ��Ӧ����B����A���Ҵﵽƽ��״̬ʱ��������ת����B����A��˵���ı�����ʱƽ�������ƶ��ҷ�Ӧ���ʼӿ죻
�۸÷�Ӧ������Ӧ�����ȷ�Ӧ�������¶�ƽ�������ƶ�����ѧƽ�ⳣ��ֻ���¶��йأ�
��2����ѧƽ�ⳣ��K����������Ũ����֮���뷴Ӧ��Ũ����֮���ıȣ�
����ƽ��ʱ���������c�� NO2��=0.4mol•L-1��������c��O2��Ϊ0.1mol/L��ʵ����c��O2��Ϊ1.3mol•L-1��˵�����������ֽ����c��O2��Ϊ1.2mol/L����Ӧ��c�� NO2��Ϊ2.4mol/L����������ת����=$\frac{�μӷ�Ӧ��c��N{O}_{2}��}{�����ɵ�c��N{O}_{2}��}$��
N2O5��g������ʼŨ��Ӧ����������ȫ�ֽ��Ũ�ȣ�
��3������������ǡ����ȫ��Ӧ�������ᣬ��Ӧ����ʽΪNO+NO2+O2+H2O=2HNO3�����ݷ���ʽ����x��
��4���ü�����һ�������¿����������������Ⱦ�����ɶ�����̼�͵�����ˮ������ת�Ƶ����غ㡢ԭ���غ���ƽ����ʽ��
��� �⣺��1����������A����Ӧ��ǰ3minv��NO2��=$\frac{��0.20-0.13��mol/L}{3min}$=0.035mol/��L��min����v��O2��=$\frac{1}{2}$ v��NO2��=$\frac{1}{2}$��0.035mol/��L��min��=0.0175mol/��L��min�����ʴ�Ϊ��0.0175mol/��L��min����
�ڷ�Ӧ����ƽ���ʱ�����̣�˵����ѧ��Ӧ����B����A���Ҵﵽƽ��״̬ʱ��������ת����B����A��˵���ı�����ʱƽ�������ƶ��ҷ�Ӧ���ʼӿ죬
����ͼ֪����Ӧ��ʼŨ�Ȳ��䣬��Ӧ�ﵽƽ��ʱ��������ת����������ʹ�ô���������ѹǿƽ�������ƶ�����������ת���ʼ�С�����Ըı������ֻ�����¶ȣ����������¶ȣ�
�ʴ�Ϊ���¶ȣ�
����A��B�ı�������������¶ȣ������¶ȶ�������ת��������˵��ƽ�������ƶ���������Ӧ�����ȷ�Ӧ�������¶�ƽ�ⳣ����������KA��KB���ʴ�Ϊ������
��2����ѧƽ�ⳣ��K����������Ũ����֮���뷴Ӧ��Ũ����֮���ıȣ���ѧƽ�ⳣ��K=$\frac{{c}^{4}��N{O}_{2}����c��{O}_{2}��}{{c}^{2}��{N}_{2}{O}_{5}��}$��
����ƽ��ʱ���������c�� NO2��=0.4mol•L-1��������c��O2��Ϊ0.1mol/L��ʵ����c��O2��Ϊ1.3mol•L-1��˵�����������ֽ����c��O2��Ϊ1.2mol/L����Ӧ��c�� NO2��Ϊ2.4mol/L����������ת����=$\frac{�μӷ�Ӧ��c��N{O}_{2}��}{�����ɵ�c��N{O}_{2}��}$=$\frac{2.4mol/L}{0.4mol/L+2.4mol/L}$=$\frac{6}{7}$��
N2O5��g������ʼŨ��Ӧ����������ȫ�ֽ��Ũ��=$\frac{2.4mol/L+0.4mol/L}{4}��2$=1.4mol/L��
�ʴ�Ϊ��K=$\frac{{c}^{4}��N{O}_{2}����c��{O}_{2}��}{{c}^{2}��{N}_{2}{O}_{5}��}$��$\frac{6}{7}$��1.4��
��3������������ǡ����ȫ��Ӧ�������ᣬ��Ӧ����ʽΪNO+NO2+O2+H2O=2HNO3�����ݷ���ʽ����x=$\frac{a+b}{2}$����ѡa��
��4���ü�����һ�������¿����������������Ⱦ�����ɶ�����̼�͵�����ˮ������ת�Ƶ����غ㡢ԭ���غ���ƽ����ʽΪ2NO2+CH4�TN2+CO2+2H2O��
�ʴ�Ϊ��2NO2+CH4�TN2+CO2+2H2O��
���� ���⿼�黯ѧƽ����㡢��������Ի�ѧƽ���ƶ�Ӱ���֪ʶ�㣬���ؿ���ѧ�������жϼ�����������ȷ�����������Ĺ�ϵˮ�Ȿ��ؼ����ѵ��ǣ�2�����������ת���ʵļ��㣬ע�����ɵ�����ΪI��II����ʽ�����������ܺͣ�Ϊ�״��㣮

 ������ÿ�ʱ�Ż���ҵϵ�д�
������ÿ�ʱ�Ż���ҵϵ�д�
������ʯ���ڲ�ͬ�¶��µ��ܽ�ȣ�g/100gˮ��������
| �¶ȣ��棩 | 20 | 40 | 60 | 80 | 100 |
| ʯ�� | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| ���� | 32 | 44.6 | 61.8 | 83.8 | 114 |
��1������ɫ��������Ҫ�ɷ���Fe��OH��3��
��2��д��������������������ͭ�Ļ�ѧ����ʽ3Cu+2HNO3+3H2SO4=3CuSO4+2NO��+4H2O��
��3������I�IJ����¶�Ӧ�ÿ�����100�����ң�
��4������Һ�з��������ͭ����IJ���IIӦΪ��ȴ�ᾧ������ ϴ�ӡ����
��5����Ӧ�����е�NO����ѭ��ʹ�ã��Խ���һ����ѧ����ʽ��ʾNOת��ΪHNO3��4NO+3O2+H2O=4HNO3��
| A�� | �Ȼ�� | B�� | ���� | C�� | ʳ�� | D�� | ������ |
| t/s | 0 | 500s | 1 000s |
| c��H2��/��mol•L-1�� | 5.00 | 3.52 | 2.48 |
| c��CO��/��mol•L-1�� | 2.50 |
��2����1 000 s����CO��ʾ�Ļ�ѧ��Ӧ������0.00126mol•L-1•s-1��1 000sʱH2��ת������50.4%��
��3����500sʱ���ɵļ״���Ũ����0.74mol•L-1��
 2013��9�£��й��������е������������ص������������������ӱ������ϵȵصĿ�����Ⱦ��Ϊ6��������Ⱦ�������ض���Ⱦ������β����ȼú����������ȡů�ŷŵ�CO2�ȶ��������γɵ�ԭ��
2013��9�£��й��������е������������ص������������������ӱ������ϵȵصĿ�����Ⱦ��Ϊ6��������Ⱦ�������ض���Ⱦ������β����ȼú����������ȡů�ŷŵ�CO2�ȶ��������γɵ�ԭ����1������β����������Ҫԭ��Ϊ��2NO��g��+2CO��g��$\stackrel{����}{?}$N2��g��+2CO2��g����H��0����һ���¶��£���һ������̶����ܱ������г���һ������NO��CO����t1ʱ�̴ﵽƽ��״̬��
�����жϸ÷�Ӧ�ﵽƽ��״̬�ı�־��CD��
A���ڵ�λʱ��������1mol CO2��ͬʱ������lmol CO
B�����������ܶȲ��ٸı�
C����������ƽ����Է����������ٸı�
D����������ѹǿ���ٱ仯
����t2ʱ�̣����������ݻ�Ѹ������ԭ����2�����������������������£�t3ʱ�̴ﵽ�µ�ƽ��״̬��֮���ٸı�����������ͼ�в��仭����t2��t4ʱ������Ӧ����ʱ��ı仯���ߣ�
����Ҫͬʱ��߸÷�Ӧ�����ʺ�NO��ת���ʣ���ȡ�Ĵ�ʩ������ѹǿ������COŨ�ȣ���д��2����
��2���ı�ú�����÷�ʽ�ɼ��ٻ�����Ⱦ��ͨ���ɽ�ˮ����ͨ�����ȵ�̼�õ�ˮú�����䷴ӦC��g��+H2O��g��?CO��g��+H2��g����H=+131.3kJ•mol-1
�ٸ÷�Ӧ�ڸ��������Է����У�����¡����¡�����
��ú���������в������к�����H2S����������Na2CO3��Һ���գ��÷�Ӧ�����ӷ���ʽΪCO32-+H2S=HCO3-+HS-��[��֪��Ka1��H2S��=9.1��10-8��Ka2��H2S��=1.1��10-12��Ka1��H2CO3��=4.3��10-7��Ka2��H2CO3��=5.6��10-11]
��3����֪��Ӧ��CO��g��+H2O��g��?CO2��g��+H2��g�����ֽ���ͬ����CO��g����H2O��g���ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������н��з�Ӧ���õ������������ݣ�
| ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ�������ʱ��/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
��ʵ��3�У���ƽ��ʱ��CO��ת���ʴ���ˮ��������a��b��������Ĺ�ϵ��a��b��
�۸÷�Ӧ�ġ�H��0 �������������������900��ʱ������һ��ʵ�飬�ڴ������м���l0mol CO��5mo1H2O��2mo1CO2��5mol H2�����ʱv��������v���棩�����������������=������
| A�� | ���ۺ͵���ø��Ϻ��� | |
| B�� | ��պ����������Ϊ75%�ľƾ������Ƥ�� | |
| C�� | �������߹�����䲡�� | |
| D�� | �ø������ֽ�����걾 |
| ʱ�䣨min�� | 0 | 1 | 2 | 3 | 4 | 5 |
| n��CuO����mol�� | 0.080 | 0.060 | 0.040 | 0.020 | 0.020 | 0.020 |
��2������˷�Ӧ��800��Cʱ�Ļ�ѧƽ�ⳣ��k=0.429
��3������ƽ������ϵ�м���CO��CO2��0.05mol�����ʱV��������V���棩
��4��������ԭCuO��CO������C��ˮ������Ӧ�Ƶã�
��֪��C��s��+O2��g��=CO2��g����H=-393.5kJ/mol
2CO��g��+O2��g��=2CO2��g����H=-566kJ/mol
2H2��g��+O2��g��=2H2O��g����H=-571.6kJ/mol
��C��s��+H2O��g��?CO��g��+H2��g����H=+175.3kj/mol��