题目内容
8.对燃煤烟气和汽车尾气进行脱硝、脱碳和脱硫等处理,可实现绿色环保、节能减排等目的.汽车尾气脱硝脱碳的主要原理为:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$N2(g)+2CO2(g)△H=a kJ•mol-1.I、已知2NO(g)+O2(g)═2NO2(g)△H=b kJ•mol-1;CO的燃烧热△H=c kJ•mol-1.写出消除汽车尾气中NO2的污染时,NO2与CO反应的热化学方程式2NO2(g)+4CO(g)=N2(g)+4CO2(g)△H=a-b+2c kJ•mol-1.
II、一定条件下,在一密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol•L-1 | 1.00 | 0.8 | 0.64 | 0.55 | 0.5 | 0.5 |
| c(CO)/mol•L-1 | 3.50 | 3.30 | 3.14 | 3.05 | 3.00 | 3.00 |

(2)前2s内的平均反应速率υ(N2)=0.09mol/(L•s)(保留两位小数,下同);此温度下,该反应的平衡常数为0.03mol•L-1.
(3)采用低温臭氧氧化脱硫脱硝技术,同时吸收SO2和NOx,获得(NH4)2SO4的稀溶液,
①常温条件下,此溶液的PH=5,则$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$=1.7×104(已知该温度下NH3•H2O的Kb=1.7×10-5)
②向此溶液中再加入少量 (NH4)2SO4固体,$\frac{c(N{{H}_{4}}^{+})}{c(S{{O}_{4}}^{2-})}$的值将变大(填“变大”、“不变”或“变小”)
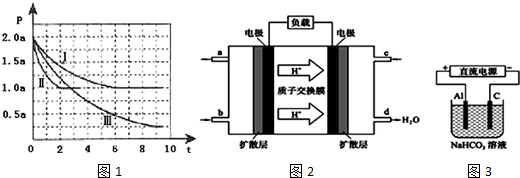
(4)设计如图1装置模拟传感器测定CO与 NO反应原理.
①铂电极为正极(填“正极”或“负极”).
②负极电极反应式为CO+O2--2e-=CO2
III、如图2所示,无摩擦、无质量的活塞1、2将反应器隔成甲、乙两部分,在25℃和101kPa下实现平衡时,各部分体积分别为V甲、V乙.此时若去掉活塞1,不引起活塞2的移动.则x=1.5,V甲:V乙=3:1.
分析 Ⅰ、已知:①2NO(g)+2CO(g)$\stackrel{催化剂}{?}$N2(g)+2CO2(g)△H=a kJ•mol-1,
②2NO(g)+O2(g)═2NO2(g)△H=b kJ•mol-1,
③CO(g)+0.5O2(g)=CO2(g)△H=c kJ•mol-1,
根据盖斯定律①-②+2×③可得2NO2(g)+4CO(g)=N2(g)+4CO2(g);
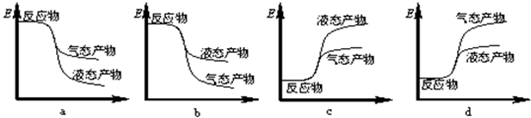
Ⅱ、(1)化学平衡状态的特征(正逆反应速率相等,各组分含量保持不变)判定,C主要图象不符和题设要求,平均摩尔质量应为恒定量;
(2)从表可知2s内NO浓度变化量为0.36mol•L-1,则N2的浓度为0.18mol/L,再有v=$\frac{△c}{△t}$计算;平衡后四种物质平衡浓度为0.5mol•L-1、3mol•L-1、0.25mol•L-1、0.5mol•L-1,根据化学平衡常数概念列式计算;
(3)①根据水解平衡常数Kh=$\frac{c(N{H}_{3}•{H}_{2}O)c({H}^{+})}{c(N{{H}_{4}}^{+})}$=$\frac{c(N{H}_{3}•{H}_{2}O)c({H}^{+})}{c(N{{H}_{4}}^{+})}•\frac{c(O{H}^{-})}{c(O{H}^{-})}$=$\frac{{K}_{w}}{{K}_{b}}$计算;
②在(NH4)2SO4溶液中存在水解反应,2NH4++H2O?NH3•H2O+H+,往(NH4)2SO4溶液中再加入少量 (NH4)2SO4固体,水解平衡向正方向进行,但铵根的水解率减小,可得;
(4)①原电池的正极判断根据N元素化合价变化情况判断,氮元素化合价降低在正极发生;
②负极失电子被氧化:CO+O2--2e-=CO2;
Ⅲ、如图2所示,无摩擦、无质量的活塞1、2将反应器隔成甲、乙两部分,说明为等压容器,对应2CO(g)+2NO(g)?N2(g)+2CO2(g)只要转化到一边成比例即等效,若去掉活塞1,不引起活塞2的移动,说明新平衡与原平衡等效,据此分析;
解答 解:Ⅰ、已知①2NO(g)+2CO(g)$\stackrel{催化剂}{?}$N2(g)+2CO2(g)△H=a kJ•mol-1
②2NO(g)+O2(g)=2NO2(g)△H=b kJ•mol-1;
③CO(g)+0.5O2(g)=CO2(g)△H=c kJ•mol-1
根据盖斯定律①-②+2×③可得2NO2(g)+4CO(g)=N2(g)+4CO2(g))△H=a-b+2c kJ•mol-1;
故答案为:2NO2(g)+4CO(g)=N2(g)+4CO2(g)△H=a-b+2c kJ•mol-1;
Ⅱ、(1)A、随着反应的进行,氮气的百分量瞪大,平衡时不再变化,故A正确;
B、△H与反应的物质的量有关,故△H改变,与图象不符,故B错误;
C、混合我替的总质量不变,该反应的混合气体的总的物质的量变小,根据$\overline{M}=\frac{m}{n}$,平均相对分子质量增大,平衡时不再改变,故C错误;
D、CO作为反应物,随着反应的进行,浓度减小,平衡时保持不变,故D正确;
故选AD;
(2)从表可知2s内NO浓度变化量为0.36mol•L-1,则N2的浓度为0.18mol/L,故其速率为$\frac{0.18mol/L}{2s}$=0.09mol•L-1•min-1;平衡后四种物质平衡浓度为0.5mol•L-1、3mol•L-1、0.25mol•L-1、0.5mol•L-1,故平衡常数K=$\frac{0.{5}^{2}×0.25}{0.5×{3}^{2}}$=0.03mol•L-1;
故答案为:0.09; 0.03mol•L-1;
(3)①水解平衡常数Kh=$\frac{c(N{H}_{3}•{H}_{2}O)c({H}^{+})}{c(N{{H}_{4}}^{+})}$=$\frac{c(N{H}_{3}•{H}_{2}O)c({H}^{+})}{c(N{{H}_{4}}^{+})}•\frac{c(O{H}^{-})}{c(O{H}^{-})}$=$\frac{Kw}{Kb}$,pH=5,c(H+)=1×10-5,则$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{c({H}^{+})}{Kh}$=$\frac{c({H}^{+})Kb}{Kw}$=$1{0}^{-5}×\frac{1.7×1{0}^{-5}}{1×1{0}^{-14}}$=1.7×104;
故答案为:1.7×104;
②在(NH4)2SO4溶液中存在水解反应,2NH4++H2O?NH3•H2O+H+,往(NH4)2SO4溶液中再加入少量 (NH4)2SO4固体,水解平衡向正方向进行,但铵根的水解率减小,所以$\frac{c(N{{H}_{4}}^{+})}{c(S{{O}_{4}}^{2-})}$的值将变大;
故答案为:变大;
(4)①氮元素化合价降低在正极发生,pt电极为正极;
②负极失电子被氧化,CO氧化为CO2,负极电极式为:CO+O2--2e-=CO2;
故答案为:正极;CO+O2--2e-=CO2;
Ⅲ、如图2所示,无摩擦、无质量的活塞1、2将反应器隔成甲、乙两部分,说明为等压容器,对应2CO(g)+2NO(g)?N2(g)+2CO2(g)只要转化到一边成比例即等效,所以有
2CO(g)+2NO(g)?N2(g)+2CO2(g);
甲起始(mol):0.6 0 x 3
转化(mol):0.6+2x 2x 0 3-2x
乙起始(mol):1.2 1 0 0
若去掉活塞1,不引起活塞2的移动,说明新平衡与原平衡等效,则3-2x=0,解得x=1.5mol,
则甲相等于3.6molCO和3molNO刚好是乙的3倍,所以V甲:V乙=3:1;
故答案为:1.5;3:1.
点评 本题考查了热化学方程式书写、速率计算、平衡常数计算、盐类水解、原电池工作原理及电极反应书写、等效平衡,综合性强,要求学生对基础知识的掌握扎实,计算较大,(3)、Ⅲ题目难度大.

| t/s | 0 | 500s | 1 000s |
| c(H2)/(mol•L-1) | 5.00 | 3.52 | 2.48 |
| c(CO)/(mol•L-1) | 2.50 |
(2)在1 000 s内用CO表示的化学反应速率是0.00126mol•L-1•s-1,1 000s时H2的转化率是50.4%.
(3)在500s时生成的甲醇的浓度是0.74mol•L-1.
(1)工业上可用CO2 和H2反应合成甲醇.已知25℃、101kPa 下:
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-242kJ/mol
CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(g)△H2=-676kJ/mol
①写出CO2与H2反应生成CH3OH(g)与H2O(g)的热化学方程式CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50 kJ/mol.下列表示该反应的能量变化的示意图中正确的是a(填字母代号).
②合成甲醇所需的H2可由下列反应制取:H2O(g)+CO(g)?H2(g)+CO2(g).某温度下该反应的平衡常数K=1.若起始时c(CO)=1mol/L,c(H2O)=2mol/L,则达到平衡时H2O的转化率为33.3%.
(2)CO和H2反应也能合成甲醇:CO(g)+2H2(g)?CH2OH(g)△H=-90.1kJ/mol.在250℃下,将一定量的CO和H2投入10L的恒容密闭容器中,各物质的浓度(mol/L)变化如表所示(前6min没有改变条件):
| 2min | 4min | 6min | 8min | … | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.2 | … |
| CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | … |
②若6~8min时只改变了一个条件,则改变的条件是加入1mol氢气,第8min时,该反应是否达到平衡状态?不是(填“是”或“不是”).
(3)甲醇在原电池上的使用,提高了燃料的利用效率,达到节能减排的目的.若用熔融的Na2CO3使作电解质、氧气作助燃剂组成的燃料电池,写出负极的电极反应式:2CH3OH-12e-+6CO32-=8CO2+4H2O.
 CO是火力发电厂释放出的主要尾气,为减少对环境污染,发电厂试图采用CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)?COCl2(g)△H=a kJ/mol
CO是火力发电厂释放出的主要尾气,为减少对环境污染,发电厂试图采用CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)?COCl2(g)△H=a kJ/mol反应过程中测定的部分数据如表:
| t/min | n (CO)/mol | n (Cl2)/mol |
| 0 | 1.20 | 0.60 |
| 1 | 0.90 | |
| 2 | 0.80 | |
| 4 | 0.20 |
(2)在2min~4min间,v(Cl2)正=v(Cl2)逆 (填“>”、“=”或“<”),该温度下K=5
(3)已知X、L可分别代表温度或压强,如图表示L一定时,CO的砖化率随X的变化关系.
X代表的物理量是温度;a<0 (填“>”,“=”,“<”),依据是因为X增大时,CO的平衡转化率降低,平衡逆向移动.
 常温下有0.1mol•L-1四种溶液NaOH、NH3•H2O、HCl、CH3COOH
常温下有0.1mol•L-1四种溶液NaOH、NH3•H2O、HCl、CH3COOH 降低大气中CO2的含量及有效地开发利用 CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
降低大气中CO2的含量及有效地开发利用 CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.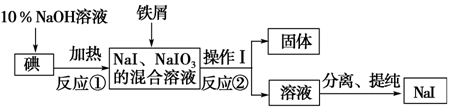
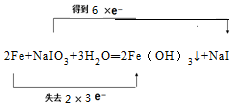 .
.