题目内容
7.对于下列各组反应,反应开始时,产生氢气速率最快的是( )| A. | 70℃,将0.1mol 镁粉加入到10mL6mol•L-1的硝酸溶液中 | |
| B. | 60℃,将0.2mol 镁粉加入到20mL3mol•L-1的盐酸溶液中 | |
| C. | 60℃,将0.1mol 镁粉加入到10mL3mol•L-1的硫酸溶液中 | |
| D. | 60℃,将0.2mol 铁粉加入到10mL3mol•L-1的盐酸溶液中 |
分析 影响化学反应速率的主要因素是物质的本身性质,对于同一个化学反应,反应物浓度越大,温度越高,反应速率越大,注意硝酸与金属反应不生成氢气.
解答 解:活泼性Mg>Fe,则Mg反应较快,硝酸与金属反应不生成氢气,C中氢离子浓度最大,且温度较高,则反应速率最大.
故选C.
点评 本题考查化学反应速率的影响因素,难度不大,注意金属的活泼性强弱,为影响反应速率的主要因素,易错点为A,注意硝酸与金属反应不生成氢气.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
17.下列叙述正确的是( )
| A. | 氯化钠溶液在电流作用下电离出钠离子与氯离子 | |
| B. | 硫酸钡难溶于水但硫酸钡属于电解质 | |
| C. | 溶于水后能电离出氢离子的化合物都是酸 | |
| D. | 水难电离,纯水几乎不导电,所以水一定不是电解质 |
12.硫酸铜是一种应用极其广泛的化工原料.以下是某工厂用含铁废铜为原料生产胆矾(CuSO4•5H2O)的生产流程示意图:

胆矾和石膏在不同温度下的溶解度(g/100g水)见表.
请回答下列问题:
(1)红棕色滤渣的主要成分是Fe(OH)3;
(2)写出浸出过程中生成硫酸铜的化学方程式3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O;
(3)操作I的操作温度应该控制在100℃左右;
(4)从溶液中分离出硫酸铜晶体的操作II应为冷却结晶、过滤 洗涤、干燥;
(5)反应产物中的NO可以循环使用,试仅用一个化学方程式表示NO转化为HNO3:4NO+3O2+H2O=4HNO3.

胆矾和石膏在不同温度下的溶解度(g/100g水)见表.
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
(1)红棕色滤渣的主要成分是Fe(OH)3;
(2)写出浸出过程中生成硫酸铜的化学方程式3Cu+2HNO3+3H2SO4=3CuSO4+2NO↑+4H2O;
(3)操作I的操作温度应该控制在100℃左右;
(4)从溶液中分离出硫酸铜晶体的操作II应为冷却结晶、过滤 洗涤、干燥;
(5)反应产物中的NO可以循环使用,试仅用一个化学方程式表示NO转化为HNO3:4NO+3O2+H2O=4HNO3.
19.与100mL0.5mol•L-1NaCl溶液中的Cl-的物质的量浓度相同的是( )
| A. | 100mL0.5mol•L-1MgCl2溶液 | B. | 100mL0.5mol•L-1 HCl溶液 | ||
| C. | 200mL0.25mol•L-1 KCl溶液 | D. | 100mL0.5mol•L-1NaClO溶液 |
16.我国宋代《开宝本草》记载了“铁华粉”的制法:“取钢煅作叶,如笏或团,平面磨错,令光净.以盐水洒之,醋瓮中阴处埋之,一百日,铁上衣生,铁华成矣.”这里的“铁华粉”是指( )
| A. | 醋酸亚铁 | B. | 硫酸亚铁 | C. | 氧化铁 | D. | 氯化铁 |
13.为了提高煤的利用率,人们先把煤转化为CO和H2,再将它们转化为甲醇,某实验人员在一定温度下的密闭容器中,充入一定量的H2和CO,发生反应:2H2(g)+CO(g)$\stackrel{催化}{→}$CH3OH(g),测定的部分实验数据如下:
(1)在500s内用H2表示的化学反应速率为0.00296mol•L-1•s-1.
(2)在1 000 s内用CO表示的化学反应速率是0.00126mol•L-1•s-1,1 000s时H2的转化率是50.4%.
(3)在500s时生成的甲醇的浓度是0.74mol•L-1.
| t/s | 0 | 500s | 1 000s |
| c(H2)/(mol•L-1) | 5.00 | 3.52 | 2.48 |
| c(CO)/(mol•L-1) | 2.50 |
(2)在1 000 s内用CO表示的化学反应速率是0.00126mol•L-1•s-1,1 000s时H2的转化率是50.4%.
(3)在500s时生成的甲醇的浓度是0.74mol•L-1.

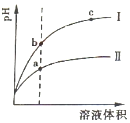 常温下有0.1mol•L-1四种溶液NaOH、NH3•H2O、HCl、CH3COOH
常温下有0.1mol•L-1四种溶液NaOH、NH3•H2O、HCl、CH3COOH