题目内容
某溶液X含有K+、Mg2+、Fe3+、Fe2+、Cl-、CO32-、NO3-、SO42-中的几种,已知该溶液中各离子物质的量浓度均为0.1mol?L-1(不考虑水的电离及离子的水解).为确定该溶液中含有的离子,现进行了如下的操作:下列说法正确的是( )
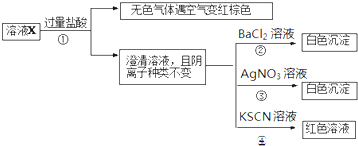

| A、无色气体可能是NO和CO2的混合物 |
| B、由步骤③可以确定原溶液中含有Cl- |
| C、溶液X中所含离子种类共有4种 |
| D、另取l00mL原溶液X,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,理论上得到的固体质量为1.2g |
考点:常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题
分析:X溶液加入盐酸,生成无色气体,气体遇到空气红棕色,则可说明生成NO,X中一定含有NO3-和还原性离子,而只有二价铁离子具有还原性,所以一定含有Fe2+,碳酸根离子与二价铁离子发生双水解生成沉淀,所以一定不含CO32-;加入盐酸后阴离子种类不变,则说明X中含有Cl-,加入氯化钡生成白色沉淀,则一定含有SO42-,加入KSCN溶液呈红色,因Fe2+被氧化成Fe3+,则不能证明X中含有Fe3+,结合各离子物质的量浓度均为0.1mol?L-1解答该题.
解答:
解:X溶液加入盐酸,生成无色气体,气体遇到空气红棕色,则可说明生成NO,X中一定含有NO3-和还原性离子Fe2+;碳酸根离子与二价铁离子发生双水解生成沉淀,所以一定不含CO32-;加入盐酸后阴离子种类不变,则说明X中含有Cl-,加入氯化钡生成白色沉淀,则一定含有SO42-;加入KSCN溶液呈红色,因Fe2+被氧化成Fe3+,则不能证明X中是否含有Fe3+,已知该溶液中各离子物质的量浓度均为0.1mol?L-1,依据阴阳离子所带电荷数守恒,可知一定含有Mg2+,不含Fe3+、K+,所以溶液中一定含有的离子为:Fe2+、Cl-、NO3-、SO42-、Mg2+,
A.二氧化氮为红棕色,而X加入盐酸反应生成的无色气体,所以一定不含二氧化氮,故A错误;
B.因为第一步加入的盐酸中含有氯离子,所以通过步骤③不能确定氯离子的存在,故B错误;
C.溶液X中所含离子:Fe2+、Cl-、NO3-、SO42-、Mg2+,共有5种,故C错误;
D.另取l00mL原溶液X,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到固体为0.005molFe2O3和0.01molMgO,质量为0.005mol×160g/mol+0.01mol×40g/mol=1.2g,故D正确;
故选:D.
A.二氧化氮为红棕色,而X加入盐酸反应生成的无色气体,所以一定不含二氧化氮,故A错误;
B.因为第一步加入的盐酸中含有氯离子,所以通过步骤③不能确定氯离子的存在,故B错误;
C.溶液X中所含离子:Fe2+、Cl-、NO3-、SO42-、Mg2+,共有5种,故C错误;
D.另取l00mL原溶液X,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到固体为0.005molFe2O3和0.01molMgO,质量为0.005mol×160g/mol+0.01mol×40g/mol=1.2g,故D正确;
故选:D.
点评:本题考查物质的推断和离子的检验,侧重于学生的分析能力和计算能力的考查,明确各种离子的性质是解题关键,注意电荷守恒在离子推断中的应用,题目难度中等.

练习册系列答案
 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案
相关题目
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、在标准状况下,11.2L 氦气含有NA个氦原子 |
| B、25℃,1.01×105Pa,64gSO2中含有的原子数为3NA |
| C、11.2L CO含有的分子数为0.5NA |
| D、1mol氧分子含有的电子数与1mol氮气含有的电子数之比为16:7 |
有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下由此可判断这四种金属的活动性顺序是( )
| 实验 装置 |  |  |  |  |
| 部分实 验现象 | a极质量减小,b极质量增大 | b极有气体产生,c极无变化 | d极溶解,c极有气体产生 | 电流从a极流向d极 |
| A、a>b>c>d |
| B、b>c>d>a |
| C、d>a>b>c |
| D、a>b>d>c |
下列关于σ键和π键的理解不正确的是( )
| A、σ键能单独形成,而π键一定不能单独形成 |
| B、σ键可以绕键轴旋转,π键一定不能绕键轴旋转 |
| C、HCl 分子中的σ键是由一个原子的s轨道和另一个原子的p轨道以“头碰头”方式重叠构建而成的 |
| D、气体单质中一定存在σ键,可能存在π键 |
在进行中和热的测定中,下列操作或说法错误的是( )
| A、不可将温度计当搅拌棒使用,也不可靠在容器内壁上 |
| B、搅拌时,环形玻璃搅拌棒应上下移动 |
| C、测量反应混合液的温度时要随时读取温度,记录下最高温度 |
| D、为了使反应完全,必须保证酸和碱恰好完全反应 |
 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线: