题目内容
下列四组实验,根据实验事实得出的结论,正确的是( )
| A、在某试液中滴加BaCl2溶液得白色沉淀,取该白色沉淀加稀硝酸不溶解,则原未知试液中一定含有S042- |
| B、在某试液中滴加NaOH溶液得白色沉淀,继续滴加该白色沉淀溶解,则原未知试液中一定含有Al3+ |
| C、在未知试液中滴加盐酸产生无色气体,将该气体通入过量澄清石灰水中得白色沉淀,则原未知试液中一定含有C032- |
| D、某未知气体通入品红溶液中,品红溶液褪色,则原气体一定是S02 |
考点:物质的检验和鉴别的基本方法选择及应用
专题:物质检验鉴别题
分析:A.不能排除AgCl的干扰;
B.根据氢氧化铝的性质判断;
C.可能存在HC03-、S032-等离子;
D.能使品红褪色的气体不一定为二氧化硫.
B.根据氢氧化铝的性质判断;
C.可能存在HC03-、S032-等离子;
D.能使品红褪色的气体不一定为二氧化硫.
解答:
解:A.不能排除AgCl的干扰,溶液也可能含有S032-,可被硝酸氧化生成S042-,故A错误;
B.氢氧化铝为两性氢氧化物,可溶于氢氧化钠溶液,故B正确;
C.可能存在HC03-、S032-等离子,故C错误;
D.能使品红褪色的气体不一定为二氧化硫,如为氯气、二氧化氮等,故D错误.
故选B.
B.氢氧化铝为两性氢氧化物,可溶于氢氧化钠溶液,故B正确;
C.可能存在HC03-、S032-等离子,故C错误;
D.能使品红褪色的气体不一定为二氧化硫,如为氯气、二氧化氮等,故D错误.
故选B.
点评:本题考查物质的检验和鉴别,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握离子的性质以及检验方法,注意排除其它离子的干扰,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
在进行中和热的测定中,下列操作或说法错误的是( )
| A、不可将温度计当搅拌棒使用,也不可靠在容器内壁上 |
| B、搅拌时,环形玻璃搅拌棒应上下移动 |
| C、测量反应混合液的温度时要随时读取温度,记录下最高温度 |
| D、为了使反应完全,必须保证酸和碱恰好完全反应 |
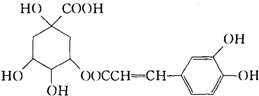 咖啡鞣酸具有较广泛的抗菌作用,其结构简式如图所示:1mol咖啡鞣酸与NaOH完全反应时可消耗 NaOH物质的量是( )
咖啡鞣酸具有较广泛的抗菌作用,其结构简式如图所示:1mol咖啡鞣酸与NaOH完全反应时可消耗 NaOH物质的量是( )| A、2 molNaOH |
| B、4 molNaOH |
| C、6 molNaOH |
| D、8 molNaOH |
现有CuO和Fe2O3组成的混合物a g,向其中加入2mol?L-1的硫酸溶液50mL,恰好完全反应.若将a g该混合物在足量H2中加热,使其充分反应,冷却后剩余固体质量为( )
| A、1.6a g |
| B、(a-1.6)g |
| C、(a-3.2)g |
| D、1.6 g |
下列说法正确的是( )
| A、常温下0.1 mol/L的下列溶液①NH4Al(SO4)2②NH3?H2O③NH4Cl ④CH3COONH4中,c(NH4+)由大到小的顺序是:①>③>④>② |
| B、常温时,pH=2的CH3COOH溶液和pH=12的氨水等体积混合;pH=2的HCl溶液和pH=12的NaOH溶液等体积混合,各混合溶液中由水电离的c(H+)一定相等 |
| C、常温下0.4mol/L HB溶液和0.2mol/L NaOH溶液等体积混合后,则混合后溶液中离子浓度的大小顺序一定为:c(B-)>c(Na+)>c(H+)>c(OH-) |
| D、0.lmol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)>c(OH-) |
下列事实不能用键能的大小来解释的是( )
| A、N元素的电负性较大,但N2的化学性质很稳定 |
| B、F2比O2更容易与H2反应 |
| C、HF、HCl、HBr、HI的稳定性逐渐减弱 |
| D、稀有气体一般难发生反应 |