题目内容
开发新能源是解决环境污染的重要举措,其中甲醇、甲烷是优质的清洁燃料,可制作燃料电池.
(1)已知:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=-1274.0kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
③H2O(g)=H2O(l)△H3=-44kJ/mol.
甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 .
(2)生产甲醇的原料CO和H2可由反应CH4(g)+H2O(g)
CO(g)+3H2(g)△H>0得到.
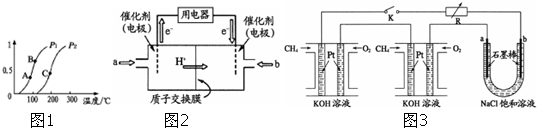
①一定条件下CH4的平衡转化率与温度、压强的关系如图1.则P1 P2(填“<”、“>”或“=”,下同).A、B、C三点处对应平衡常数(KA、KB、KC)的大小顺序为 .
②100°C时,将1molCH4和2molH2O通入容积为1L的定容密闭容器中发生反应,能说明该反应已经达到平衡状态的是 (填序号).
a.容器的压强恒定
b.容器内气体密度恒定
c.3v正(CH4)=v逆(H2)
d.单位时间内消耗0.1molCH4同时生成0.3molH2
(3)甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图2所示:通入a气体的电极是原电池的 极(填“正”或“负”),其电极反应式为 .
(4)某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图3所示U形管中氯化钠溶液的体积为800ml.闭合K后,若每个电池甲烷用量均为0.224L(标况),且反应完全,则理论上通过电解池的电量为 (列式计算.法拉第常数F=9.65×104C/mol),若产生的气体全部逸出,电解后溶液混合均匀,电解后U形管中溶液的pH为 .
(1)已知:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=-1274.0kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ/mol
③H2O(g)=H2O(l)△H3=-44kJ/mol.
甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为
(2)生产甲醇的原料CO和H2可由反应CH4(g)+H2O(g)
| ||
①一定条件下CH4的平衡转化率与温度、压强的关系如图1.则P1
②100°C时,将1molCH4和2molH2O通入容积为1L的定容密闭容器中发生反应,能说明该反应已经达到平衡状态的是
a.容器的压强恒定
b.容器内气体密度恒定
c.3v正(CH4)=v逆(H2)
d.单位时间内消耗0.1molCH4同时生成0.3molH2
(3)甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图2所示:通入a气体的电极是原电池的
(4)某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图3所示U形管中氯化钠溶液的体积为800ml.闭合K后,若每个电池甲烷用量均为0.224L(标况),且反应完全,则理论上通过电解池的电量为

考点:化学平衡的影响因素,用盖斯定律进行有关反应热的计算,原电池和电解池的工作原理
专题:
分析:(1)根据热化学方程式利用盖斯定律计算反应热并书写热化学方程式;
(2)①在200℃时,看不同压强下CO的转化率大小,结合化学方程式中反应前后气体的体积变化解答;正反应吸热,随温度升高,平衡正向移动,化学平衡常数K增大;
②可逆反应达到平衡状态时,正逆反应速率相等各组分浓度保持不变;
(3)根据图知,交换膜是质子交换膜,则电解质溶液呈酸性,根据氢离子移动方向知,通入a的电极为负极、通入b的电极为正极,负极上甲醇失去电子发生氧化反应;
(4)电解氯化钠溶液的化学方程式为2NaCl+2H2O
2NaOH+H2↑+Cl2↑,可知关系式1 mol CH4~8 mol e-~8molNaOH计算.
(2)①在200℃时,看不同压强下CO的转化率大小,结合化学方程式中反应前后气体的体积变化解答;正反应吸热,随温度升高,平衡正向移动,化学平衡常数K增大;
②可逆反应达到平衡状态时,正逆反应速率相等各组分浓度保持不变;
(3)根据图知,交换膜是质子交换膜,则电解质溶液呈酸性,根据氢离子移动方向知,通入a的电极为负极、通入b的电极为正极,负极上甲醇失去电子发生氧化反应;
(4)电解氯化钠溶液的化学方程式为2NaCl+2H2O
| ||
解答:
解:(1)根据盖斯定律,将已知反应①-②-③×4得到CH3OH(l)+O2(g)=CO(g)+2H2O(l),所以该反应的△H=(-1274.0kJ/mol)-(-566.0kJ/mol)-(-44.0kJ/mol)×4=442kJ?mol-1,即CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442kJ?mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442kJ?mol-1;
(2)①在图a的200℃位置,平行与纵轴画一条虚线,可见CH4的转化率P1>P2,在CH4(g)+H2O(g)?CO(g)+3H2(g)反应中,生成物的气体体积大于反应物,压强增大时平衡向逆向移动,故P1<P2,正反应吸热,随温度升高,平衡正向移动,化学平衡常数K增大,所以Ka<Kb<Kc,
故答案为:<;Ka<Kb<Kc;
②可逆反应达到平衡状态时,正逆反应速率相等各组分浓度保持不变,
a.反应前后气体体积不同,所以容器的压强恒定时反应达到平衡状态,故a正确;
b.容器体积不变,气体质量不变,所以容器内气体密度始终恒定,故b错误;
c.3v正(CH4)=v逆(H2),说明正逆反应速率相等,反应达到平衡状态,故c正确;
d.单位时间内消耗0.1molCH4同时生成0.3molH2,都是正反应速率,不能说明反应达到平衡状态,故d错误;
故答案为:ac;
(3)根据图知,交换膜是质子交换膜,则电解质溶液呈酸性,根据氢离子移动方向知,通入a的电极为负极、通入b的电极为正极,负极上甲醇失去电子发生氧化反应,负极反应式为 CH3OH-6e-+H2O=CO2+6H+,正极上氧气得电子发生还原反应,电极反应式为O2+4e-+4H+=2H2O,
故答案为:负;CH3OH-6e-+H2O=CO2+6H+;
(4)电解氯化钠溶液的化学方程式为2NaCl+2H2O
2NaOH+H2↑+Cl2↑,可知关系式1 mol CH4~8 mol e-~8molNaOH,故若每个电池甲烷通入量为0.224L(标准状况),生成0.08molNaOH,c(NaOH)=
=0.1mol/L,pH=13;电解池通过的电量为
×8×9.65×104C?mol-1=7.72×103C(题中虽然有两个燃料电池,但电子的传递量只能用一个池的甲烷量计算),
故答案为:
×8×9.65×104C?mol-1=7.72×103C;13.
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442kJ?mol-1;
(2)①在图a的200℃位置,平行与纵轴画一条虚线,可见CH4的转化率P1>P2,在CH4(g)+H2O(g)?CO(g)+3H2(g)反应中,生成物的气体体积大于反应物,压强增大时平衡向逆向移动,故P1<P2,正反应吸热,随温度升高,平衡正向移动,化学平衡常数K增大,所以Ka<Kb<Kc,
故答案为:<;Ka<Kb<Kc;
②可逆反应达到平衡状态时,正逆反应速率相等各组分浓度保持不变,
a.反应前后气体体积不同,所以容器的压强恒定时反应达到平衡状态,故a正确;
b.容器体积不变,气体质量不变,所以容器内气体密度始终恒定,故b错误;
c.3v正(CH4)=v逆(H2),说明正逆反应速率相等,反应达到平衡状态,故c正确;
d.单位时间内消耗0.1molCH4同时生成0.3molH2,都是正反应速率,不能说明反应达到平衡状态,故d错误;
故答案为:ac;
(3)根据图知,交换膜是质子交换膜,则电解质溶液呈酸性,根据氢离子移动方向知,通入a的电极为负极、通入b的电极为正极,负极上甲醇失去电子发生氧化反应,负极反应式为 CH3OH-6e-+H2O=CO2+6H+,正极上氧气得电子发生还原反应,电极反应式为O2+4e-+4H+=2H2O,
故答案为:负;CH3OH-6e-+H2O=CO2+6H+;
(4)电解氯化钠溶液的化学方程式为2NaCl+2H2O
| ||
| 0.8mol |
| 0.8L |
| 0.224L |
| 22.4L/mol |
故答案为:
| 0.224L |
| 22.4L/mol |
点评:本题涵盖热化学、电化学主体内容,涉及电极判断与电极反应式书写等问题,做题时注意从氧化还原的角度判断原电池的正负极以及电极方程式的书写,本题中难点和易错点为电极方程式的书写.

练习册系列答案
相关题目
某实验报告记录了如下数据,其中数据合理的是( )
| A、用温度计测量出酒精的沸点为78.5℃ |
| B、用50mL量筒量取23.00 mL浓盐酸 |
| C、用广泛pH试纸测得氯水的pH值为2.1 |
| D、用托盘天平称量氧化铜粉末为11.70g |
根据酸碱质子理论,凡是能给出质子的分子或离子都是酸,凡是能结合质子的分子或离子都是碱.按照这个理论,下列微粒属于两性物质的是( )
| A、HCO3- |
| B、CO32- |
| C、Fe(OH)3 |
| D、CH3COOH |
现有一瓶物质甲和乙的混合物,已知甲和乙的某些性质如下表.
据此,将甲和乙互相分离的最佳方法是( )
| 物质 | 分子式 | 熔点/℃ | 沸点/℃ | 密度/g?cm-3 | 水中溶解性 |
| 甲 | C3H6O2 | -98 | 57.5 | 0.93 | 可溶 |
| 乙 | C4H8O2 | -84 | 77 | 0.90 | 可溶 |
| A、萃取法 | B、升华法 |
| C、蒸馏法 | D、分液法 |
下列有关说法正确的是( )
| A、反应SiO2(s)+3C(s)=SiC(s)+2CO(g)室温下不能自发进行,则该反应的△H<0 |
| B、配制硫酸亚铁溶液时,需将FeSO4?7H2O先溶于硝酸再用蒸馏水稀释,最后加少量铁粉 |
| C、0.1 mol?L-1Na2CO3溶液加蒸馏水稀释,CO32-的水解程度增大,溶液的pH减小 |
| D、在硫酸钡悬浊液中加入足量饱和Na2CO3溶液处理,向所得沉淀中加入盐酸有气体产生,说明Ksp(BaSO4)>Ksp(BaCO3) |

 2013年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一.
2013年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一.