题目内容
如何证明一瓶无色溶液是Al2(SO4)3溶液,简述操作步骤,写出有关反应的化学方程式.
考点:物质的检验和鉴别的基本方法选择及应用
专题:物质检验鉴别题
分析:Al2(SO4)3溶液可与氢氧化钠反应生成Al(OH)3,Al(OH)3为两性氢氧化物,如氢氧化钠过量,则进一步反应生成NaAlO2,沉淀溶解,以此检验Al3+,然后取溶液于另一试管中,先加入盐酸,如无现象,再加入氯化钡溶液,如生成沉淀,可说明含有SO42-,以此解答.
解答:
解:证明一瓶无色溶液是Al2(SO4)3溶液,可将Al2(SO4)3溶液于一小试管中,逐滴滴加氢氧化钠溶液,可观察到首先生成白色絮状沉淀,后溶解,以此检验Al3+,发生的方程式为Al2(SO4)3+6NaOH=2Al(OH)3+3Na2SO4、Al(OH)3+NaOH=NaAlO2+2H2O,然后取溶液于另一试管中,先加入盐酸,如无现象,再加入氯化钡溶液,如生成沉淀,可说明含有SO42-,发生反应的方程式为Al2(SO4)3+3BaCl2=2AlCl3+BaSO4↓,
答:将Al2(SO4)3溶液于一小试管中,逐滴滴加氢氧化钠溶液,可观察到首先生成白色絮状沉淀,后溶解,以此检验Al3+,然后取溶液于另一试管中,先加入盐酸,如无现象,再加入氯化钡溶液,如生成沉淀,可说明含有SO42-,发生的方程式为Al2(SO4)3+6NaOH=2Al(OH)3+3Na2SO4、Al(OH)3+NaOH=NaAlO2+2H2O、Al2(SO4)3+3BaCl2=2AlCl3+BaSO4↓.
答:将Al2(SO4)3溶液于一小试管中,逐滴滴加氢氧化钠溶液,可观察到首先生成白色絮状沉淀,后溶解,以此检验Al3+,然后取溶液于另一试管中,先加入盐酸,如无现象,再加入氯化钡溶液,如生成沉淀,可说明含有SO42-,发生的方程式为Al2(SO4)3+6NaOH=2Al(OH)3+3Na2SO4、Al(OH)3+NaOH=NaAlO2+2H2O、Al2(SO4)3+3BaCl2=2AlCl3+BaSO4↓.
点评:本题考查物质的检验和鉴别,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握氢氧化铝的两性,难度不大.

练习册系列答案
相关题目
下列关于仪器使用的说法正确的是( )
| A、滴定管装滴定液时应先用滴定液润洗 |
| B、锥形瓶用作反应容器时一定不能加热 |
| C、蒸馏时温度计水银球可以高于蒸馏瓶支管口 |
| D、振摇分液漏斗时只需要塞上其玻璃塞 |
砹(At)属于卤族元素之一,试推测砹(At)单质及其化合物不可能具有的性质是( )
| A、单质砹易溶于某些有机溶剂 |
| B、AgAt是不溶于水的有色固体 |
| C、HAtO4酸性比HClO4强 |
| D、HAt难溶于水,且受热很难分解 |
下列物质中,既能跟盐酸反应,又能跟氢氧化钠反应的物质有( )
①Al ②Al2O3 ③Al(OH)3 ④(NH4)2SO4 ⑤Al2(SO4)3 ⑥KHCO3.
①Al ②Al2O3 ③Al(OH)3 ④(NH4)2SO4 ⑤Al2(SO4)3 ⑥KHCO3.
| A、①②③⑤ | B、②③④⑥ |
| C、①②③⑥ | D、①②③④⑥ |
已知常温下CH3COOH和NH3?H2O的电离常数相等,向10mL浓度为0.1mol/L的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中( )
| A、水的电离程度始终增大 | ||
B、
| ||
| C、c(CH3COOH)与c(CH3COO-)之和始终保持不变 | ||
| D、当加入氨水的体积为10 mL时,c(NH4+)=c(CH3COO-) |


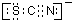 ,离子反应为:SCN-+8Cl2+9H2O=SO42-+NO3-+16Cl-+18H++CO2;
,离子反应为:SCN-+8Cl2+9H2O=SO42-+NO3-+16Cl-+18H++CO2;