题目内容
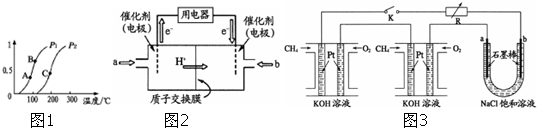
如图1所示,A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,C、D为电解槽,其电极材料及电解质溶液见图.

(1)关闭K1,打开K2,通电后,B的KMnO4紫红色液滴向c端移动,则电源b端为 极,通电开始时,滤纸d端的电极反应式是: ;
(2)已知C装置中溶液为Cu(NO3)2和X(NO3)3,且均为0.1mol,打开K1,关闭K2,通电一段时间后,阴极析出固体质量m(g)与通过电子的物质的量n(mol)关系如图2所示.则Cu2+、X3+、H+氧化能力由大到小的顺序是 ;D装置中溶液是H2SO4,则此装置电极C端的实验现象是: .

(1)关闭K1,打开K2,通电后,B的KMnO4紫红色液滴向c端移动,则电源b端为
(2)已知C装置中溶液为Cu(NO3)2和X(NO3)3,且均为0.1mol,打开K1,关闭K2,通电一段时间后,阴极析出固体质量m(g)与通过电子的物质的量n(mol)关系如图2所示.则Cu2+、X3+、H+氧化能力由大到小的顺序是
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)关闭K1,打开K2,为电解饱和食盐水装置,通电后,B的KMnO4紫红色液滴向c端移动,根据电解池工作原理可知阴离子向阳极移动判断电源的正负极并书写d端的电极反应式;
(2)打开K1,关闭K2,则为电解C、D两池,根据电解C的图象可知,开始即析出固体,总共0.2mol电子通过时,析出固体质量达最大,证明此时析出的固体是铜,此后,继续有电子通过,不再有固体析出,说明X3+不放电,H+放电,从而判断离子氧化性;D装置中溶液是H2SO4,电极C端与b负极相连即为阴极,开始氢离子得电子生成氢气,后阳极的铜失电子生成铜离子进入阴极在阴极析出,据此分析.
(2)打开K1,关闭K2,则为电解C、D两池,根据电解C的图象可知,开始即析出固体,总共0.2mol电子通过时,析出固体质量达最大,证明此时析出的固体是铜,此后,继续有电子通过,不再有固体析出,说明X3+不放电,H+放电,从而判断离子氧化性;D装置中溶液是H2SO4,电极C端与b负极相连即为阴极,开始氢离子得电子生成氢气,后阳极的铜失电子生成铜离子进入阴极在阴极析出,据此分析.
解答:
解:(1)据题意B的KMnO4紫红色液滴向c端移动,说明高锰酸根离子向c端移动,可推出极c端为阳极,则与之相连的电源a端为正极,b端为负极,所以通电滤纸d端为阴极,电极反应式为2H++2e-=H2↑,故答案为:负;2H++2e-=H2↑;
(2)根据电解C的图象可知,通电后就有固体生成,当通过电子为0.2mol时,析出固体质量达最大,证明此时析出的固体是铜.如果是X3+析出,电子数应该是0.3mol,则氧化能力为Cu2+>X3+,当电子超过0.2mol时,固体质量没变,说明这是阴极产生的是氢气,即电解水,说明氧化能力H+>X3+,故氧化能力为Cu2+>H+>X3+;
D装置中溶液是H2SO4,电极C端与b负极相连即为阴极,开始为氢离子得电子生成氢气,后阳极的铜失电子生成铜离子进入阴极在阴极析出,所以看到的现象为在C端开始时有无色无味气体产生,一段时间后有红色物质析出;故答案为:Cu2+>H+>X3+;在C端开始时有无色无味气体产生,一段时间后有红色物质析出;
(2)根据电解C的图象可知,通电后就有固体生成,当通过电子为0.2mol时,析出固体质量达最大,证明此时析出的固体是铜.如果是X3+析出,电子数应该是0.3mol,则氧化能力为Cu2+>X3+,当电子超过0.2mol时,固体质量没变,说明这是阴极产生的是氢气,即电解水,说明氧化能力H+>X3+,故氧化能力为Cu2+>H+>X3+;
D装置中溶液是H2SO4,电极C端与b负极相连即为阴极,开始为氢离子得电子生成氢气,后阳极的铜失电子生成铜离子进入阴极在阴极析出,所以看到的现象为在C端开始时有无色无味气体产生,一段时间后有红色物质析出;故答案为:Cu2+>H+>X3+;在C端开始时有无色无味气体产生,一段时间后有红色物质析出;
点评:本题综合考查电解原理以及根据图象获取信息、运用知识综合分析能力,根据KMnO4紫红色液滴向c端移动判断电源的正负极为解答该题的关键,注意电极方程式的判断,为易错点,题目难度中等.

练习册系列答案
相关题目
暴露在空气中不易变质的物质是( )
| A、氯水 | B、漂白粉 |
| C、纯碱 | D、亚硫酸钠 |
下列反应属于化合反应的是( )
| A、SO3+H2O=H2SO4 |
| B、Zn+2HCl=ZnCl2+H2↑ |
| C、Fe+CuSO4=FeSO4+Cu |
| D、KCl+AgNO3=KNO3+AgCl↓ |
下列关于仪器使用的说法正确的是( )
| A、滴定管装滴定液时应先用滴定液润洗 |
| B、锥形瓶用作反应容器时一定不能加热 |
| C、蒸馏时温度计水银球可以高于蒸馏瓶支管口 |
| D、振摇分液漏斗时只需要塞上其玻璃塞 |
砹(At)属于卤族元素之一,试推测砹(At)单质及其化合物不可能具有的性质是( )
| A、单质砹易溶于某些有机溶剂 |
| B、AgAt是不溶于水的有色固体 |
| C、HAtO4酸性比HClO4强 |
| D、HAt难溶于水,且受热很难分解 |
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、常温常压下,16 g O2含有NA个氧原子 |
| B、1mol苯含有3NA个碳碳单键和3NA个碳碳双键 |
| C、一定条件下,3molH2和1molN2充分反应后,可得到2NA个NH3分子数 |
| D、1 mol?L-1FeCl3溶液中含有Cl-总数为3NA |
 化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.
化学在能源开发与利用中起着十分关键的作用.氢气是一种新型的绿色能源,又是一种重要的化工原料.