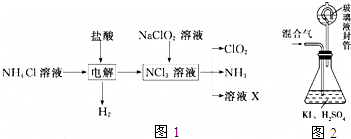
题目内容
9.一氧化碳、氢气都是重要的化工原料,又可作为燃料.生产水煤气(主要成分为CO和H2)过程中发生的主要反应如下:①C(g)+CO2(g)?2CO(g)△H1②CO(g)+H2O(g)?H2(g)+CO2(g)△H2
③C(s)+H2O(g)?CO(g)+H2(g)△H3
回答下列问题:
| 化学键 | C≡O | H-O | H-H | C═O |
| E/(kJ.mol-1) | a | b | c | d |
(2)反应③的化学平衡常数K的表达式为K=$\frac{c(CO)•c({H}_{2})}{c({H}_{2}O)}$;上述反应中△H1、△H2、△H3之间的关系为△H3=△H1+△H2.
(3)不同温度下反应②的平衡常数如下表所示,则△H2<0(填“<”或“>”)
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
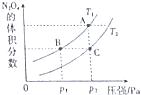
(4)对于反应2NO2(g)?N2O4(g)△H<0,当温度为T1、T2时,平衡体系中的体积分数随压强变化的曲线如图所示,则T1<T2(填“<”或“>”);压强增大,平衡向正(填“正”或“逆”)反应方向移动,B、C两点的平衡常数B>C(填“>”、“<”或“=”)
分析 (1)反应热=反应物总键能-生成物总键能,据此计算出△H2;
(2)根据反应③及平衡常数的概念写出该化学平衡常数K;应用盖斯定律找出△H1、△H2、△H3之间的关系;
(3)①由表可知,温度越高,平衡常数越小,反应进行程度越小,平衡向逆反应移动,升高温度平衡向吸热方向移动;
②到达平衡时转化率最大,令平衡时CO的浓度变化量为cmol/L,根据三段式法用c表示出平衡时各组分个浓度,再利用平衡常数列方程,求出c,再利用转化率定义计算;
(4)相同压强时,温度越高,平衡向逆反应方向移动,则四氧化二氮的物质的量减小,据此判断温度高低;
相同温度时,增大压强平衡向正反应方向移动,四氧化二氮的体积分数减小;
温度越高,平衡向逆反应方向移动,则化学平衡常数越小.
解答 解:(1)热化学方程式②CO(g)+H2O(g)?H2(g)+CO2(g)的△H2=反应物总键能-生成物总键能=(a+2b-c-2d)kJ•mol-1,
故答案为:(a+2b-c-2d)kJ•mol-1;
(2)③C(s)+H2O(g)?CO(g)+H2(g)的平衡常数表达式为:K=$\frac{c(CO)•c({H}_{2})}{c({H}_{2}O)}$;
根据盖斯定律由①+②可得方程式:C(s)+H2O(g)?CO(g)+H2(g),所以△H3=△H1+△H2,
故答案为:K=$\frac{c(CO)•c({H}_{2})}{c({H}_{2}O)}$;△H3=△H1+△H2;
(3)①由表可知,温度越高,平衡常数越小,反应进行程度越小,平衡向逆反应移动,升高温度平衡向吸热方向移动,该正反应为放热反应,则△H2<0,
故答案为:<;
②设CO的浓度变化量为c,三段式法用c表示出平衡时各组分个浓度,
CO(g)+H2O(g)?H2(g)+CO2(g),
起始(mol/L):0.02 0.020 0 0
转化(mol/L):c c c c
平衡(mol/L):0.02-c 0.02-c c c
500℃时,反应平衡常数有K=$\frac{c×c}{(0.02-c)×(0.02-c)}$=9,解得:c=0.015,
CO的最大所以转化率为:$\frac{0.015mol/L}{0.02mo/L}$=75%,
故答案为:75%;
(4)该反应为放热反应,相同压强时,温度越高,平衡向逆反应方向移动,则四氧化二氮的物质的量减小,所以T1<T2;
该反应为气态体积减小的反应,相同温度时,增大压强平衡向正反应方向移动,四氧化二氮的体积分数减小;
温度影响平衡常数,该反应为放热反应,温度越高,平衡向逆反应方向移动,则生成物浓度越小、反应物浓度越大,所以化学平衡常数减小,T1<T2,所以B的平衡常数大于C点,
故答案为:<;正;>.
点评 本题考查了化学平衡的计算,题目难度较大,涉及化学平衡及其影响因素、盖斯定律在热化学方程式中的应用、化学平衡的计算等知识,注意掌握盖斯定律的含义及应用方法,明确三段式在化学平衡计算中的应用方法.

| A. | 氯化铝与氨水反应:Al3++3OH-═Al(OH)3↓ | |
| B. | 稀硫酸与氢氧化钡溶液反应:H++OH-+Ba2++SO42-═H2O+BaSO4↓ | |
| C. | 碳酸钙与稀盐酸反应:CO32--+2H+═H2O+CO2↑ | |
| D. | 向苏打溶液中加入足量的醋酸:CO32-+2CH3COOH═CO2↑+H2O+2CH3COO- |
| A. | Al-Al2O3-Al(OH)3-NaAlO2 | B. | S-SO3-H2SO4-MgSO4 | ||
| C. | Mg-MgCl2-Mg(OH)2-MgO | D. | Si-SiO2-H2SiO3-Na2 SiO3 |
| 温度/℃ | 压强/kPa | Z的质量分数 |
| 200 | 101 | 0.40 |
| 300 | 101 | 0.48 |
| 400 | 202 | 0.52 |
| 400 | 303 | 0.52 |
| A. | 3X(g)+Y(g)?3Z(g)△H>0 | B. | X(g)+3Y(g)?4Z(g)△H<0 | C. | 3X(g)+Y(g)?4Z(g)△H>0 | D. | X(g)+3Y(g)?3Z(g)△H<0 |
| A. | 114号元素在周期表中第七周期第VIA族,属于金属元素 | |
| B. | 晶体硅熔点高硬度大,可用于制作光导纤维 | |
| C. | 为了除去MgCl2酸性溶液中的Fe3+而得到较纯净的MgCl2溶液,可在加热搅拌的条件下加入MgCO3,过滤后,再向滤液中加入适量的盐酸 | |
| D. | 光束通过下列分散系①有尘埃的空气②明矾溶液③墨水④稀豆浆时,都能产生丁达尔效应 |
| A. | K+ | B. | Na+ | C. | K元素 | D. | Na元素 |