题目内容
1.用铂丝蘸取某物质进行灼烧,透过蓝色钴玻璃观察,火焰呈紫色,可以判断该物质中含有( )| A. | K+ | B. | Na+ | C. | K元素 | D. | Na元素 |
分析 透过蓝色钴玻璃观察到火焰呈紫色,说明含有钾离子,蓝色玻璃可滤去黄光.
解答 解:焰色反应是元素的性质.透过蓝色钴玻璃观察到火焰呈紫色,说明含有钾元素,蓝色玻璃可滤去黄光.
故选C.
点评 本题考查焰色反应,题目难度不大,注意实验原理的考查,明确蓝色钴玻璃的作用是解题的关键.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
9.一氧化碳、氢气都是重要的化工原料,又可作为燃料.生产水煤气(主要成分为CO和H2)过程中发生的主要反应如下:①C(g)+CO2(g)?2CO(g)△H1
②CO(g)+H2O(g)?H2(g)+CO2(g)△H2
③C(s)+H2O(g)?CO(g)+H2(g)△H3
回答下列问题:
则△H2=(a+2b-c-2d)kJ•mol-1kJ.mol-1(用含a,b,c,d字母的代数式表示).
(2)反应③的化学平衡常数K的表达式为K=$\frac{c(CO)•c({H}_{2})}{c({H}_{2}O)}$;上述反应中△H1、△H2、△H3之间的关系为△H3=△H1+△H2.
(3)不同温度下反应②的平衡常数如下表所示,则△H2<0(填“<”或“>”)
500℃时,若起始时密闭容器中充有物质的量浓度均为0.02mol•L-1的CO和H2O.则反应②达到化学平衡时CO的转化率为75%.
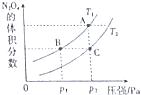
(4)对于反应2NO2(g)?N2O4(g)△H<0,当温度为T1、T2时,平衡体系中的体积分数随压强变化的曲线如图所示,则T1<T2(填“<”或“>”);压强增大,平衡向正(填“正”或“逆”)反应方向移动,B、C两点的平衡常数B>C(填“>”、“<”或“=”)
②CO(g)+H2O(g)?H2(g)+CO2(g)△H2
③C(s)+H2O(g)?CO(g)+H2(g)△H3
回答下列问题:
| 化学键 | C≡O | H-O | H-H | C═O |
| E/(kJ.mol-1) | a | b | c | d |
(2)反应③的化学平衡常数K的表达式为K=$\frac{c(CO)•c({H}_{2})}{c({H}_{2}O)}$;上述反应中△H1、△H2、△H3之间的关系为△H3=△H1+△H2.
(3)不同温度下反应②的平衡常数如下表所示,则△H2<0(填“<”或“>”)
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
(4)对于反应2NO2(g)?N2O4(g)△H<0,当温度为T1、T2时,平衡体系中的体积分数随压强变化的曲线如图所示,则T1<T2(填“<”或“>”);压强增大,平衡向正(填“正”或“逆”)反应方向移动,B、C两点的平衡常数B>C(填“>”、“<”或“=”)

12.今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、CO32-、SO42-,现取两份100mL溶液进行如下实验:
①第一份加过量NaOH溶液加热后,只收集到气体0.02mol,无沉淀生成,同时得到溶液甲.
②在甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02g.
③第二份加足量BaCl2溶液后,得白色沉淀,沉淀经足量盐酸洗涤、干燥后,质量为11.65g.
根据上述实验回答:
(1)一定不存在的离子是Fe3+、Mg2+、CO32-、Ba2+.
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
(3)试确定K+是否存在是(填“是”或“否”),判断的理由是溶液中肯定存在的离子Al3+、NH4+、SO42-,经计算Al3+、NH4+物质的量都是0.02mol,SO42-物质的量是0.05mol,根据电荷守恒,K+一定存在.
①第一份加过量NaOH溶液加热后,只收集到气体0.02mol,无沉淀生成,同时得到溶液甲.
②在甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02g.
③第二份加足量BaCl2溶液后,得白色沉淀,沉淀经足量盐酸洗涤、干燥后,质量为11.65g.
根据上述实验回答:
(1)一定不存在的离子是Fe3+、Mg2+、CO32-、Ba2+.
(2)试确定溶液中一定存在的阴离子及其物质的量浓度(可不填满):
| 阴离子符号 | 物质的量浓度(mol•L-1) |
9.已知常温下,在溶液中发生如下反应,由此推断下列说法正确的是( )
①16H++10Z-+2XO4-═2X2++5Z2+8H2O;
②2A2++B2═2A3-+2B-;
③2B-+Z2═B2+2Z-.
①16H++10Z-+2XO4-═2X2++5Z2+8H2O;
②2A2++B2═2A3-+2B-;
③2B-+Z2═B2+2Z-.
| A. | Z元素在反应①中被还原,在反应③中被氧化 | |
| B. | 反应Z2+2A2+═2A3++2Z-可以进行 | |
| C. | 氧化性由强到弱的顺序是XO4-,Z2,B2,A3+ | |
| D. | 还原性由强到弱的顺序是Z-,B-,A2+,X2+ |
16.六种短周期元素A、B、C、D、E、F的原子序数依次增大,其中A与E,B与F同主族,E与F同周期;D的核电荷数是F的最外层电子数的2倍;B的最高正价与最低负价的代数和为0;常温下单质A与E的状态不同.下列判断正确的是( )
| A. | A、D两种元素形成的化合物中只含有极性键 | |
| B. | A、C、D三种元素形成的化合物一定是共价化合物,其溶液一定呈酸性 | |
| C. | 原子半径由大到小的顺序是F>E>C>D | |
| D. | 最高价氧化物对应水化物酸性最强的元素是C |
6.以下实验操作简便、科学且成功的是( )
| A. | 将乙酸和乙醇的混合物注入浓硫酸中制备乙酸乙酯 | |
| B. | 将铜丝在酒精灯的外焰上加热变黑后,插入乙醇溶液中铜丝又恢复到原来的红色 | |
| C. | 往试管中注入2mLCuSO4溶液,再滴几滴NaOH溶液后,加入乙醛溶液即有红色沉淀产生 | |
| D. | 向淀粉溶液中加入稀硫酸加热,一段时间后,再加入银氨溶液检验是否水解 |
11.下列对定量实验误差分析正确的是( )
| A. | 中和热测定实验中,缓慢地将NaOH溶液倒入测定装置中--测定结果无影响 | |
| B. | 酸碱中和滴定实验中,滴定前无气泡而滴定后有气泡--测定结果偏高 | |
| C. | 测定溶液pH的实验中,用干燥pH试纸测定新制氯水的pH--测定结果无影响 | |
| D. | 现需90 mL 1.0 mol/L NaOH溶液,称取3.6 g NaOH 固体配制--溶液浓度偏低 |
 某化学兴趣小组用如图所示装置进行电化学原理的实验探究,回答下列问题:
某化学兴趣小组用如图所示装置进行电化学原理的实验探究,回答下列问题: