题目内容
17.在等体积、等pH的Ba(OH)2、NaOH和NH3•H2O三种溶液中,滴加等浓度的盐酸,它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是( )| A. | V3>V2>V1 | B. | V1>V2=V3 | C. | V3>V2=V1 | D. | V1=V2>V3 |
分析 等体积、等pH的Ba(OH)2、NaOH中,c(OH-)相同,但NH3•H2O为弱碱,等pH时,其浓度大于NaOH,然后结合酸碱中和时c(OH-)越大,消耗酸越多,以此解答该题.
解答 解:等体积、等pH的Ba(OH)2、NaOH中,c(OH-)相同,滴加等浓度的盐酸将它们恰好中和,用去酸的体积V1=V2,
但NH3•H2O为弱碱,等pH时,其浓度大于NaOH,滴加等浓度的盐酸将它们恰好中和,弱碱继续电离产生氢氧根离子,则消耗酸多,即V2<V3,
所以消耗酸的体积关系为V3>V2=V1,
故选C.
点评 本题考查酸碱混合的计算,为高频考点,侧重考查学生的分析、计算能力,明确pH与浓度的关系及强碱、弱碱的判断、弱碱的电离平衡是解答本题的关键,题目难度中等.

练习册系列答案
相关题目
7.以下处理方法正确的是( )
| A. | 金属钠着火,用水或CO2灭火器灭火 | |
| B. | 少量白磷保存在煤油中 | |
| C. | 不小心把水银洒落在地面,盖沙处理 | |
| D. | 硝酸银保存在棕色试剂瓶中 |
8.有机物A是一种重要的化工原料,其结构简式为: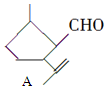 ,下列检验A中官能团的试剂和顺序正确的是( )
,下列检验A中官能团的试剂和顺序正确的是( )
 ,下列检验A中官能团的试剂和顺序正确的是( )
,下列检验A中官能团的试剂和顺序正确的是( )| A. | 先加溴水,再加KMnO4酸性溶液 | |
| B. | 先加入足量的新制Cu(OH)2悬浊液,微热,酸化后再加溴水 | |
| C. | 先加银氨溶液,微热,再加溴水 | |
| D. | 先加KMnO4酸性溶液,再加银氨溶液,微热 |
5.用CCl4 把碘从碘水中提取出来的方法是( )
| A. | 萃取 | B. | 过滤 | C. | 蒸发 | D. | 蒸馏 |
9.需要配制2mol/L的NaCl溶液480mL,配制时应选用的容量瓶的规格和称取的NaCl质量分别是( )
| A. | 480mL,56.2g | B. | 500mL,56.2g | C. | 500mL,58.5g | D. | 任意规格,56.2g |
6.在不同浓度(℃)、温度(T)条件下,蔗糖水解的瞬时速率(v)如下表,下列判断不正确的是( )
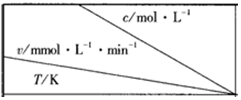 | 0.600 | 0.500 | 0.400 | a |
| 318.2 | 3.60 | c | 2.40 | 1.80 |
| 328.2 | 9.00 | 7.50 | d | 4.50 |
| b | 2.16 | 1.80 | 1.44 | 1.08 |
| A. | a<0.400 | B. | c>2.40 | C. | b<318.2 | D. | d<1.44 |
8.下列说法正确的是( )
| A. | 氯水和二氧化硫都具有漂白作用,两者漂白原理相同 | |
| B. | 等质量的铜粉按a、b两种途径完全转化,途径a和途径b消耗的H2SO4相等途径a:Cu$→_{△}^{O_{2}}$CuO$\stackrel{稀H_{2}SO_{4}}{→}$;途径b:Cu$→_{△}^{浓H_{2}SO_{4}}$CuSO4 | |
| C. | 1molNa与O2完全反应生成Na2O和Na2O2的混合物,转移电子NA,生成物中离子总数为1.5NA | |
| D. | 从海水中提取物质都必须通过化学反应才能实现 |
 元素铜在溶液中主要以[Cu(H2O)4]2+(天蓝色)、[Cu(OH)4]2-(蓝色)、[CuCl2]-、[Cu(NH3)4]2+(深蓝色)等形式存在.CuCl为难溶于水的白色固体.回答下列问题:
元素铜在溶液中主要以[Cu(H2O)4]2+(天蓝色)、[Cu(OH)4]2-(蓝色)、[CuCl2]-、[Cu(NH3)4]2+(深蓝色)等形式存在.CuCl为难溶于水的白色固体.回答下列问题: