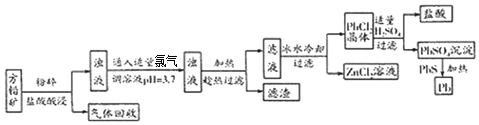
题目内容
8.下列说法正确的是( )| A. | 氯水和二氧化硫都具有漂白作用,两者漂白原理相同 | |
| B. | 等质量的铜粉按a、b两种途径完全转化,途径a和途径b消耗的H2SO4相等途径a:Cu$→_{△}^{O_{2}}$CuO$\stackrel{稀H_{2}SO_{4}}{→}$;途径b:Cu$→_{△}^{浓H_{2}SO_{4}}$CuSO4 | |
| C. | 1molNa与O2完全反应生成Na2O和Na2O2的混合物,转移电子NA,生成物中离子总数为1.5NA | |
| D. | 从海水中提取物质都必须通过化学反应才能实现 |
分析 A.二氧化硫漂白作用是二氧化硫、水和有色物质化合生成一种不稳定的无色物质;
B.途径b中浓硫酸既是氧化剂又呈酸性,酸性的硫酸与途径a相同;
C.1molNa无论生成氧化钠还是过氧化钠,钠都由0价变成+1价,而氧化钠和过氧化钠中阴阳离子的个数之比都为1:2;
D.在自然界中以游离态存在的单质不需要用化学反应提取.
解答 解:A.次氯酸能将有色物质氧化为无色物质,二氧化硫漂白作用是二氧化硫、水和有色物质化合生成一种不稳定的无色物质,漂白原理不相同,故A错误;
B.途径b中浓硫酸既是氧化剂又呈酸性,酸性的硫酸与途径a相同,所以b消耗硫酸的量大,故B错误;
C.1molNa无论生成氧化钠还是过氧化钠,钠都由0价变成+1价,而氧化钠和过氧化钠中阴阳离子的个数之比都为1:2,所以1molNa与O2完全反应生成Na2O和Na2O2的混合物,转移电子NA,生成物中离子总数为1.5NA,故C正确;
D.在自然界中以游离态存在的单质不需要用化学反应提取,故D错误.
故选C.
点评 本题考查较综合,多角度考查元素化合物知识,为高考常见题型,题目涉及诸多社会热点问题,注重化学与生活的联系,题目难度不大,注意知识的积累.

练习册系列答案
 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
17.在等体积、等pH的Ba(OH)2、NaOH和NH3•H2O三种溶液中,滴加等浓度的盐酸,它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是( )
| A. | V3>V2>V1 | B. | V1>V2=V3 | C. | V3>V2=V1 | D. | V1=V2>V3 |
18.在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)?zC(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,在达到平衡时,测得A的浓度降低为0.30mol/L.下列说法正确的是( )
| A. | 平衡向正反应方向移动 | B. | x+y<z | ||
| C. | B的转化率升 | D. | C的体积分数下降 |
3.设NA代表阿伏加德罗常数,下列说法不正确的是( )
| A. | 1.5 mol NO2与足量的H2O反应,转移的电子数为NA | |
| B. | 常温常压下,0.5NA个CO2分子质量为22 g | |
| C. | 1 mol/L的CH3COOH中CH3COO-的浓度小于1 mol/L,而1 mol/L CH3COONa中CH3COO-等于1 mol/L | |
| D. | 18g 18O2中含有的中子数为10NA |
13.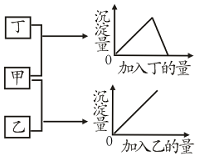 甲、乙、丙、丁四种溶液分别是FeSO4、Al2(SO4)3、KOH、BaCl2四种物质中的一种,若将其中一种溶液滴入另一种溶液中,现象如图,据此可判断丙物质是( )
甲、乙、丙、丁四种溶液分别是FeSO4、Al2(SO4)3、KOH、BaCl2四种物质中的一种,若将其中一种溶液滴入另一种溶液中,现象如图,据此可判断丙物质是( )
 甲、乙、丙、丁四种溶液分别是FeSO4、Al2(SO4)3、KOH、BaCl2四种物质中的一种,若将其中一种溶液滴入另一种溶液中,现象如图,据此可判断丙物质是( )
甲、乙、丙、丁四种溶液分别是FeSO4、Al2(SO4)3、KOH、BaCl2四种物质中的一种,若将其中一种溶液滴入另一种溶液中,现象如图,据此可判断丙物质是( )| A. | Al2(SO4)3 | B. | NaOH | C. | FeSO4 | D. | BaCl2 |
20.有A、B、C、D、E五种常见化合物,都是由表中的离子形成的:
为了鉴别上述化合物,分别完成以下实验,其结果是:①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;③进行焰色反应,仅有B、C为紫色(透过蓝色钴玻璃);④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,只有A中放出无色气体,只有C、D中产生白色沉淀;⑤将B、D两溶液混合,未见沉淀或气体生成.根据上述实验填空:
(1)写出C、D的化学式:CKAl(SO4)2,DCuSO4.
(2)向C溶液中加入过量E溶液,反应的离子方程式为Al3++4OH-=AlO2-+2H2O.
(3)检验C中阴离子的方法:取少量C溶液于试管中,先加稀盐酸,再加BaCl2溶液.
| 阳离子 | K+ | Na+ | Cu2+ | Al3+ |
| 阴离子 | SO42- | HCO3- | NO3- | OH- |
(1)写出C、D的化学式:CKAl(SO4)2,DCuSO4.
(2)向C溶液中加入过量E溶液,反应的离子方程式为Al3++4OH-=AlO2-+2H2O.
(3)检验C中阴离子的方法:取少量C溶液于试管中,先加稀盐酸,再加BaCl2溶液.
18.已知室温时,某一元酸HA的Ka 约为1×10-7,下列叙述正确的是( )
| A. | 0.1mol/LHA溶液的pH=3.5 | |
| B. | 0.1mol/LHA溶液中,由HA电离出的c(H+)约为水电离出的c(H+)的106倍 | |
| C. | 0.1mol/LNaA溶液中,各离子浓度大小顺序为:c(Na+)>c(OH-)>c(A-)>c(H+) | |
| D. | 向0.1mol/LNaA溶液中加水稀释,所有离子浓度均降低 |