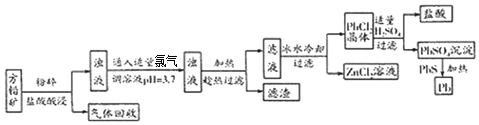
题目内容
6.在不同浓度(℃)、温度(T)条件下,蔗糖水解的瞬时速率(v)如下表,下列判断不正确的是( )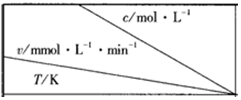 | 0.600 | 0.500 | 0.400 | a |
| 318.2 | 3.60 | c | 2.40 | 1.80 |
| 328.2 | 9.00 | 7.50 | d | 4.50 |
| b | 2.16 | 1.80 | 1.44 | 1.08 |
| A. | a<0.400 | B. | c>2.40 | C. | b<318.2 | D. | d<1.44 |
分析 由表中数据可知,在相同温度下,速率与浓度呈正比,在相同浓度下,温度升高,速率增大,以此解答该题.
解答 解:A.由表中数据可知,318.2℃时,$\frac{0.600}{3.60}$=$\frac{a}{1.80}$,a=0.3,故A正确;
B.318.2℃时,$\frac{0.600}{3.60}$=$\frac{0.500}{c}$,c=3.00,故B正确;
C.由表可知温度由328.2℃→b,在浓度相同的情况下,水解速率变小,所以温度降低,所以温度b<318.2,故C正确;
D.由表可知温度由318.2→328.2℃,在浓度相同的情况下$\frac{{v}_{318.2}}{{v}_{328.2}}$=0.4,所以d=$\frac{2.4}{0.4}$=6,故D错误.
故选D.
点评 本题考查较综合,涉及反应速率计算、影晌速率的因素分析等,侧重学生表格数据分析及计算能力的考查,注重对高考高频考点的训练,题目难度中等.

练习册系列答案
相关题目
16.二氧化氯(ClO2)是国际上公认的安全、无毒的绿色消毒剂,对酸性污水中的Mn2+也有明显的去除效果,其反应原理为:ClO2+Mn2+→MnO2↓+Cl- (部分反应物和产物省略、未配平),下列有关该反应的说法正确的是( )
| A. | 工业上可用更为廉价的Cl2来代替ClO2 | |
| B. | 利用该原理处理含Mn2+的污水后溶液的pH升高 | |
| C. | 该反应中氧化产物和还原产物的物质的量之比为2:5 | |
| D. | 理论上处理含1mol Mn2+的污水,需要标准状况下的ClO28.96L |
17.在等体积、等pH的Ba(OH)2、NaOH和NH3•H2O三种溶液中,滴加等浓度的盐酸,它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是( )
| A. | V3>V2>V1 | B. | V1>V2=V3 | C. | V3>V2=V1 | D. | V1=V2>V3 |
14.某溶液可能含有下列6种离子中的某几种:Cl-、SO42-、HCO3-、Na+、K+、Mg2+,所含离子的浓度均相等.为了确认溶液的组成,进行如下实验:
①取100mL上述溶液,加入足量Ba(OH)2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.88g.
②向沉淀中加入过量的盐酸,有2.33g沉淀不溶解.
则下列结论不正确的是( )
①取100mL上述溶液,加入足量Ba(OH)2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.88g.
②向沉淀中加入过量的盐酸,有2.33g沉淀不溶解.
则下列结论不正确的是( )
| A. | 原溶液一定存在SO42-、HCO3-、Mg2+,至少存在Na+、K+中的一种 | |
| B. | 若要证明原溶液中是否存在 Cl-,可在第①步的滤液中加硝酸酸化后再加硝酸银溶液 | |
| C. | 加Ba(OH)2溶液中使原溶液中的离子恰好反应且完全沉淀时,混合液呈中性 | |
| D. | 第②步实验中共消耗0.04mol HCl |
11.下列实验操作错误的是( )
| A. |  实验室中制取少量乙酸乙酯 | B. |  比较非金属性S>C>Si | ||
| C. |  处理尾气 | D. |  闭合开关K形成原电路 |
18.在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)?zC(g),平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,在达到平衡时,测得A的浓度降低为0.30mol/L.下列说法正确的是( )
| A. | 平衡向正反应方向移动 | B. | x+y<z | ||
| C. | B的转化率升 | D. | C的体积分数下降 |