题目内容
5.同温同压下,将1体积的CO2和2体积的CO的混合,则CO2与CO的:(1)分子数之比是1:2;
(2)原子数之比是3:4;
(3)质量之比是11:14;
(4)物质的量之比是1:2;
(5)电子数之比是11:14;
(6)平均摩尔质量是33.3g/mol;
(7)混合气体的密度对氢气的相对密度是$\frac{50}{3}$.
分析 (1)同温同压下,气体分子数目之比等于体积之比;
(2)同温同压下,气体体积之比等于物质的量之比,结合分子含有原子数目计算;
(3)同温同压下,气体体积之比等于物质的量之比,再根据m=nM计算;
(4)同温同压下,气体体积之比等于物质的量之比;
(5)二氧化碳分子中含有22个电子,CO分子中含有14个电子,结合二者的物质的量之比计算出含有电子数之比;
(6)根据二者的物质的量之比计算出其平均摩尔质量;
(7)密度与摩尔质量成正比,根据(6)计算出的平均摩尔质量计算出该混合气体的密度对氢气的相对密度.
解答 解:(1)同温同压下,气体分子数目之比等于体积之比,故1体积的CO2和2体积的CO含有分子数目之比=1:2,
故答案为:1:2;
(2)同温同压下,气体体积之比等于物质的量之比,故1体积的CO2和2体积的CO的物质的量之比=1:2,则二者含有原子数目之比=1×3:2×2=3:4,
故答案为:3:4;
(3)同温同压下,气体体积之比等于物质的量之比,故1体积的CO2和2体积的CO的物质的量之比=1:2,则二者质量之比=1mol×44g/mol:2mol×28g/mol=11:14,故答案为:11:14;
(4)同温同压下,气体体积之比等于物质的量之比,则二者物质的量之比为1:2,
故答案为:1:2;
(5)根据(4)可知二者物质的量之比为1:2,二者含有的电子数之比=电子的物质的量之比=(1×22):(2×14)=11:14,
故答案为:11:14;
(6)根据(4)可知二者物质的量之比为1:2,则二者的平均摩尔质量=$\frac{44g/mol×1+28g/mol×2}{3}$=$\frac{100}{3}$g/mol=33.3g/mol,
故答案为:33.3g/mol;
(7)密度与摩尔质量成正比,混合气体的密度对氢气的相对密度=$\frac{100}{3}$g/mol:2g/mol=$\frac{50}{3}$,
故答案为:$\frac{50}{3}$.
点评 本题考查物质的量有关计算、阿伏伽德罗定律及推论,题目难度不大,根据pV=nRT理解阿伏伽德罗定律及推论,试题有利于提高学生的分析能力及化学计算能力.

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案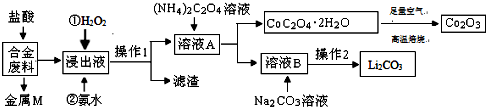
(1)金属M为Cu.
(2)加入H2O2的作用是(用离子方程式表示)2Fe2++H2O2+2H+=2Fe3++2H2O,加入氨水的作用是调节溶液的pH使Fe3+转化为Fe(OH)3沉淀.
(3)CoC2O4•2H2O高温焙烧的化学方程式为4CoC2O4?2H2O+3O2$\frac{\underline{\;焙烧\;}}{\;}$2Co2O3+8H2O+8CO2.
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表.操作2中,蒸发浓缩后必须趁热过滤,其原因是减少Li2CO3的溶解损失,90℃时Ksp(Li2CO3)的值为4.0×10-3.
| 温度/℃ | 10 | 30 | 60 | 90 |
| 浓度/mol?L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
| A. | 2X2Q(g)+O2(g)═2Q(s)+2X2O(g)△H=-2a kJ•mol-1 | |
| B. | X2Q(g)+2O2(g)═QO3(g)+X2O(l)△H=+a kJ•mol-1 | |
| C. | 2X2Q(g)+3O2(g)═2QO2(g)+2X2O(l)△H=-2a kJ•mol-1 | |
| D. | X2Q(g)+2O2(g)=QO3(g)+X2O(l)△H=-a kJ•mol-1 |
| A. | 分子中共含有6个极性键 | B. | 分子中不含非极性键 | ||
| C. | 分子中只含σ键 | D. | 分子中含有π键 |
| A. | 氯水中:2c(Cl2)=c(ClO-)+c(Cl-)+c(HClO) | |
| B. | 水的离子积常数Kw 随着温度的升高而增大,说明水的电离是放热反应 | |
| C. | 醋酸溶液的pH=a,将此溶液稀释10倍后,溶液的pH=b,则b<a+1 | |
| D. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(Na+)最小的是Na2CO3 |
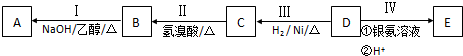
 ;
; ;
; 和
和 .
.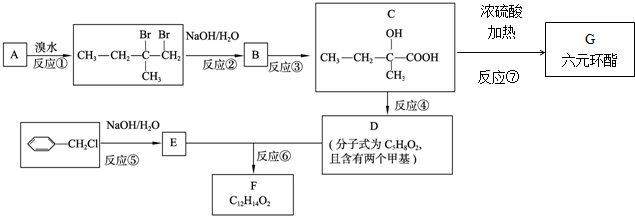
 .
.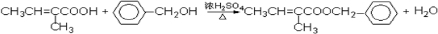 .
.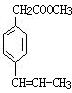 、
、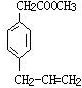 、
、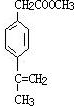 .
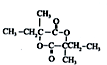
.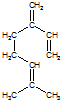 ,也可简写为
,也可简写为 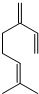 ,其分子式是C10H16,可以发生的化学反应有①④(选填序号).
,其分子式是C10H16,可以发生的化学反应有①④(选填序号).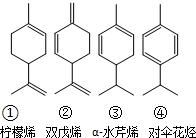
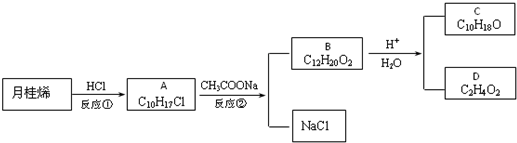
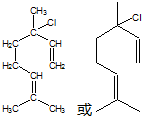 .
. .
.