题目内容
10.次磷酸钠(NaH2PO2)可用于化学镀镍,即通过化学反应在塑料镀件表面沉积镍-磷合金.(1)化学镀镍的溶液中含有Ni2+ 和H2PO2-,在酸性条件下发生以下镀镍反应:
①1 Ni2++1 H2PO2-+1H2O→1Ni+1 H2PO3-+2H+
②6H2PO-2+2H+→2P+4H2PO3-+3H2↑
请配平反应式①.
(2)反应式①中氧化剂是Ni2+,被氧化元素是P.
(3)反应②中,若生成1mol H2PO3-,反应中转移电子的物质的量为2mol.
(4)从二个化学镀镍反应分析,若生成1mol Ni和1molP,同时有3mol H2PO3-生成.
分析 (1)镍元素的化合价降低了2价,磷元素的化合价升高的2价,根据原子守恒结合电荷守恒可得配平的方程式;
(2)化合价降低元素所在的反应物是氧化剂,化合价升高元素在反应中被氧化;
(3)根据化合价变化来确定电子转移情况;
(4)根据反应方程式来确定物质的量之间的关系.
解答 解:(1)反应①中镍元素的化合价降低了2价,磷元素的化合价升高的2价,由电子、电荷守恒及原子守恒可知,离子反应为Ni2++H2PO2-+1H2O═Ni+1H2PO3-+2H+,
故答案为:1;1;1H2O;1;1;2H+;
(2)反应式①中Ni的化合价降低,所以氧化剂是Ni2+,P元素的化合价升高,所以被氧化元素是P,故答案为:Ni2+;P;
(3)1mol H2PO3-,反应中转移电子的物质的量为1mol×(4-2)=2mol,故答案为:2mol;
(4)从二个化学镀镍反应分析,若生成1molNi会生成1molH2PO3-,若生成1molP会生成2molH2PO3-,共生成3molH2PO3-,
故答案为:3.
点评 本题考查学生氧化还原反应的配平以及电子守恒的计算,注意题目信息的应用是关键,难度中等.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案
相关题目
20.下列关于物质的量、摩尔质量的叙述中正确的是( )
| A. | 0.012 kg 12C中含有约 6.02×1023 个碳原子 | |
| B. | 1 mol H2O中含有2 mol氢和1 mol氧 | |
| C. | 氢氧化钠的摩尔质量等于它的相对分子质量 | |
| D. | 2 mol水的摩尔质量是1 mol水的摩尔质量的2倍 |
18.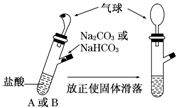 有A、B两个完全相同的装置,某学生分别在它们的侧管中装入1.06g Na2 CO3 和0.84g NaHCO3,A、B中分别有10mL相同浓度的盐酸,将两个侧管中的物质同时倒入各自的试管中下列叙述正确的是( )
有A、B两个完全相同的装置,某学生分别在它们的侧管中装入1.06g Na2 CO3 和0.84g NaHCO3,A、B中分别有10mL相同浓度的盐酸,将两个侧管中的物质同时倒入各自的试管中下列叙述正确的是( )
 有A、B两个完全相同的装置,某学生分别在它们的侧管中装入1.06g Na2 CO3 和0.84g NaHCO3,A、B中分别有10mL相同浓度的盐酸,将两个侧管中的物质同时倒入各自的试管中下列叙述正确的是( )
有A、B两个完全相同的装置,某学生分别在它们的侧管中装入1.06g Na2 CO3 和0.84g NaHCO3,A、B中分别有10mL相同浓度的盐酸,将两个侧管中的物质同时倒入各自的试管中下列叙述正确的是( )| A. | A装置的气球膨胀速率大 | |
| B. | 若最终两气球体积相同,则盐酸的浓度一定大于或等于2 mol/L | |
| C. | 若最终两气球体积不同,则盐酸的浓度一定小于或等于1 mol/L | |
| D. | 最终两试管中Na +、Cl - 的物质的量一定相同 |
13.某有机物结构简式为: ,它不可能发生的反应类型( )
,它不可能发生的反应类型( )
 ,它不可能发生的反应类型( )
,它不可能发生的反应类型( )| A. | 取代 | B. | 氧化 | C. | 水解 | D. | 酯化 |
14.己知下列反应的能量变化示意图如下,下列有关说法正确的是( )
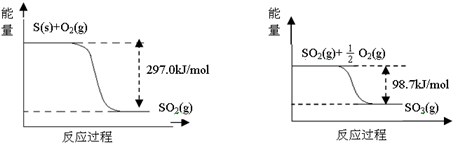

| A. | 1molS(g)与O2(g)完全反应生成SO2(g),反应放出的热量<297.0kJ | |
| B. | 在相同条件下,SO3(g)比SO2(g)稳定 | |
| C. | 1molSO2(g)和$\frac{1}{2}$molO2(g)生成1molSO3(g)放出98.7kJ的热量 | |
| D. | 由图得S(s)+$\frac{3}{2}$O2(g)?SO3(g)△H=-198.3kJ/mol |
 ;B是常见的液态化合物,其稀溶液易被催化分解,可使用的催化剂为AB.(填序号)
;B是常见的液态化合物,其稀溶液易被催化分解,可使用的催化剂为AB.(填序号)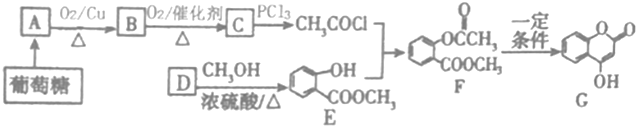
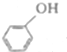 +NaOH→
+NaOH→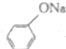 +H2O
+H2O .
.