题目内容
9.下列叙述正确的是( )| A. | 氯水中:2c(Cl2)=c(ClO-)+c(Cl-)+c(HClO) | |
| B. | 水的离子积常数Kw 随着温度的升高而增大,说明水的电离是放热反应 | |
| C. | 醋酸溶液的pH=a,将此溶液稀释10倍后,溶液的pH=b,则b<a+1 | |
| D. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(Na+)最小的是Na2CO3 |
分析 A.在氯水中存在三个平衡,使得氯水具有多样性:①Cl2+H2O?HCl+HClO ②HClO?H++ClO- ③H2O?H++OH-,氯元素守恒书写物料守恒判断;
B.水的电离过程为吸热过程;
C.醋酸为弱酸,加水稀释促进电离;
D.对应酸的酸性越弱,其盐的水解程度越大,溶液的碱性越强,溶液pH越大;当pH相同时,酸越强,盐的浓度越大.
解答 解:A.在氯水中存在三个平衡,使得氯水具有多样性:①Cl2+H2O?HCl+HClO ②HClO?H++ClO- ③H2O?H++OH-,氯元素守恒得到氯水中:c(Cl2)=2c(ClO-)+2c(Cl-)+2c(HClO),故A错误;
B.水的离子积常数Kw 随着温度的升高而增大,说明氢离子和氢氧根离子浓度增大,说明水的电离是吸热反应,故B错误;
C.醋酸为弱酸,加水稀释促进电离,应为b<a+1,故C正确;
D.pH相等的CH3COONa、NaOH和Na2CO3三种溶液,已知酸性:CH3COOH>H2CO3,所以水解程度:Na2CO3>CH3COONa,pH相同时,溶液的浓度:Na2CO3<CH3COONa,NaOH是强碱.c(Na+)最小,故D错误.
故选C.
点评 本题考查了电解质溶液中离子浓度大小、水的电离及其影响因素,盐类水解原理等知识点,掌握基础是解题关键,题目难度中等.

练习册系列答案
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
20.已知乙酸与乙酸乙酯的混合物中含氢的质量分数为7%,则含O的质量分数是( )
| A. | 42% | B. | 44% | C. | 51% | D. | 91.9% |
17.n mol H2与n mol D2气体不同之处是( )
| A. | 物质的量 | B. | 原子数 | C. | 质量 | D. | 体积(相同状况) |
4.下列有关认识正确的是( )
| A. | s、p、d、f各能级的轨道数目分别为1、3、5、7 | |
| B. | 各电子层的能级都是从s能级开始至 f 能级结束 | |
| C. | 各电子层含有的能级数为(n-1) | |
| D. | 各电子层含有的电子数为2n2 |
14.己知下列反应的能量变化示意图如下,下列有关说法正确的是( )
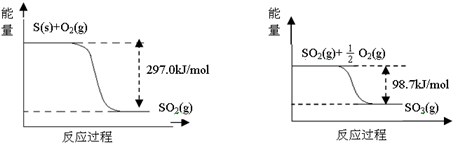

| A. | 1molS(g)与O2(g)完全反应生成SO2(g),反应放出的热量<297.0kJ | |
| B. | 在相同条件下,SO3(g)比SO2(g)稳定 | |
| C. | 1molSO2(g)和$\frac{1}{2}$molO2(g)生成1molSO3(g)放出98.7kJ的热量 | |
| D. | 由图得S(s)+$\frac{3}{2}$O2(g)?SO3(g)△H=-198.3kJ/mol |
1.决定金属性强弱的是( )
| A. | 金属原子最外层电子的个数 | |
| B. | 1 mol金属与酸反应放出氢气的多少 | |
| C. | 1 mol金属失去电子的多少 | |
| D. | 金属原子失去电子的难易程度 |
18.我国科学家通过测量SiO2中26Al和10Be两种元素的比例来确定“北京人”年龄,这种测量方法叫铝铍测年法.关于26Al和10Be的说法不正确的是( )
| A. | 10Be和9Be是中子数不同质子数相同的不同原子 | |
| B. | 10Be的原子核内中子数比质子数多 | |
| C. | 2.6g26Al3+中所含的电子数约为6.02×1023 | |
| D. | 26Al3+和26Mg2+的质子数、中子数和电子数均不相同 |
19.下列应用利用了氧化还原反应原理的是( )
| A. | 用“84消毒液”进行消毒 | |
| B. | 用浓硫酸干燥二氧化硫气体 | |
| C. | 用活性炭吸附新装修居室里的有害气体 | |
| D. | 用小苏打治疗胃酸过多 |