题目内容
某同学在实验室中进行如表实验:
以下结论正确的是( )
| 编号 | I | Ⅱ | Ⅲ |
| 实验 | 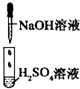 |
 |
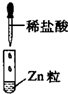 |
| 现象 | 没有明显变化,溶液仍为无色 | 有白色沉淀生成,溶液为蓝色 | 有无色气体放出 |
| A、I中混合前后溶液中各离子种类、个数均不变 |
| B、Ⅱ中反应前后溶液中Cu2+、Cl-浓度均未变 |
| C、Ⅱ中BaCl2替换为Ba(NO3)2溶液,发生的离子反应相同 |
| D、Ⅲ中发生的反应属于置换反应,不属于离子反应 |
考点:化学实验方案的评价
专题:实验评价题
分析:I中发生酸碱中和反应生成硫酸钠和水,由硫酸转化为硫酸钠,离子种类变化;Ⅱ中发生复分解反应生成硫酸钡沉淀和氯化铜,溶液的总体积变大;Ⅲ中发生Zn与盐酸的置换反应,氢离子参加反应,以此来解答.
解答:
解:A.由硫酸转化为硫酸钠,离子种类变化,但离子个数不变,故A错误;
B.生成硫酸钡沉淀和氯化铜,溶液的总体积变大,则溶液中Cu2+、Cl-离子个数不变,但浓度减小,故B错误;
C.Ⅱ中BaCl2替换为Ba(NO3)2溶液,离子反应均为Ba2++SO42-=BaSO4↓,故C正确;
D.Ⅲ中发生Zn与盐酸的置换反应,氢离子参加反应,为离子反应,故D错误;
故选C.
B.生成硫酸钡沉淀和氯化铜,溶液的总体积变大,则溶液中Cu2+、Cl-离子个数不变,但浓度减小,故B错误;
C.Ⅱ中BaCl2替换为Ba(NO3)2溶液,离子反应均为Ba2++SO42-=BaSO4↓,故C正确;
D.Ⅲ中发生Zn与盐酸的置换反应,氢离子参加反应,为离子反应,故D错误;
故选C.
点评:本题以实验形式考查实验方案的评价,为高频考点,把握实验中发生的化学反应为解答的关键,侧重离子反应及物质的量浓度、离子个数判断的考查,注重分析能力的训练,题目难度不大.

练习册系列答案
相关题目
下列书写正确的是( )
| A、硫化钠水解:S2-+2H2O?H2S+2OH- |
| B、碳酸钠与醋酸溶液反应:CO32-+2H+=H2O+CO2↑ |
| C、HCO3-的电离:H2O+HCO3-?CO32-+H3O+ |
| D、NaHS在水中的电离:NaHS?Na++HS- HS-?H++S2- |
下列物质中,含有共价键的离子化合物是( )
| A、NaOH |
| B、H2 |
| C、CaCl2 |
| D、Na2S |
某元素原子核外电子排布为:第二层上的电子数比第一层与第三层电子数之和的两倍还多2,该元素是( )
| A、Na | B、Mg | C、Al | D、Cl |
下列各组性质的比较中正确的是( )
| A、酸性 HClO4<HBrO4<HIO4 |
| B、碱性 NaOH>Mg(OH)2>Al(OH)3 |
| C、稳定性 HCl>PH3>H2S |
| D、还原性 Cl->Br->I- |
下列说法正确的是( )
| A、1H、2H、3H互为同位素 |
| B、O2、O3互为同位素 |
C、氮分子的电子式 |
| D、酸性:H2SO4>HClO4 |
 某条件下,在2L密闭容器中发生如下反应:2NO2(g)?2NO(g)+O2(g)△H>0.在三种不同条件下进行,其中NO、O2的起始浓度都为0mol?L-1,实验Ⅰ、Ⅱ反应温度相同,NO2的浓度(mol?L-1)随时间(min)的变化如图所示.
某条件下,在2L密闭容器中发生如下反应:2NO2(g)?2NO(g)+O2(g)△H>0.在三种不同条件下进行,其中NO、O2的起始浓度都为0mol?L-1,实验Ⅰ、Ⅱ反应温度相同,NO2的浓度(mol?L-1)随时间(min)的变化如图所示.