题目内容
下列各组性质的比较中正确的是( )
| A、酸性 HClO4<HBrO4<HIO4 |
| B、碱性 NaOH>Mg(OH)2>Al(OH)3 |
| C、稳定性 HCl>PH3>H2S |
| D、还原性 Cl->Br->I- |
考点:非金属在元素周期表中的位置及其性质递变的规律,金属在元素周期表中的位置及其性质递变的规律
专题:元素周期律与元素周期表专题
分析:元素周期表中,同周期元素从左到右金属性逐渐减弱,非金属性逐渐增强,同主族元素从上到下金属性逐渐增强,非金属性逐渐减弱,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,元素的非金属性越强,对应的最高价氧化物的水化物的酸性逐渐增强,以此解答.
解答:
解:A.Cl、Br、I位于周期表同一主族,元素的非金属性Cl>Br>I,元素的非金属性越强,对应的最高价氧化物的水化物的酸性越强,故A错误;
B.Na、Mg、Al位于周期表相同周期,金属性Na>Mg>Al,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,故B正确;
C.P、S、Cl位于同一周期,非金属性P<S<Cl,元素的非金属性越强,对应的氢化物的稳定性越强,故C错误;
D.非金属性Cl>Br>I,元素的非金属性越强,对应的阴离子的还原性越弱,应为 Cl-<Br-<I-,故D错误.
故选B.
B.Na、Mg、Al位于周期表相同周期,金属性Na>Mg>Al,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,故B正确;
C.P、S、Cl位于同一周期,非金属性P<S<Cl,元素的非金属性越强,对应的氢化物的稳定性越强,故C错误;
D.非金属性Cl>Br>I,元素的非金属性越强,对应的阴离子的还原性越弱,应为 Cl-<Br-<I-,故D错误.
故选B.
点评:本题考查元素周期律的递变规律,侧重于学生的分析能力和基本概念的理解和运用的考查,为高考高频考点,注意把握元素的性质与对应单质、化合物的性质的关系,把握金属性、非金属性的比较角度,难度不大.

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目
某同学在实验室中进行如表实验:
以下结论正确的是( )
| 编号 | I | Ⅱ | Ⅲ |
| 实验 | 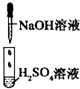 |
 |
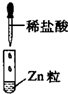 |
| 现象 | 没有明显变化,溶液仍为无色 | 有白色沉淀生成,溶液为蓝色 | 有无色气体放出 |
| A、I中混合前后溶液中各离子种类、个数均不变 |
| B、Ⅱ中反应前后溶液中Cu2+、Cl-浓度均未变 |
| C、Ⅱ中BaCl2替换为Ba(NO3)2溶液,发生的离子反应相同 |
| D、Ⅲ中发生的反应属于置换反应,不属于离子反应 |
下列物质中既有离子键又有共价键的是( )
| A、KBr |
| B、H2SO4 |
| C、NaOH |
| D、N2 |
下列说法正确的是( )
| A、增大压强,活化分子数增多 |
| B、升高温度,活化分子百分数增大 |
| C、使用催化剂能降低反应热 |
| D、加入反应物,使活化分子百分数增加,化学反应速率增大 |
下列各组物质中,两种物质分子数相同的是( )
| A、1gH2和8gO2 |
| B、18gH2O和22.4LCO2(标准状况) |
| C、0.5molHCl和11.2LCO(20℃101kPa时) |
| D、6.02×1023个H2分子和0.5molN2 |
在实验室中,下列除去杂质的方法正确的是( )
| A、溴苯中混有溴,加入KI溶液,用汽油萃取 |
| B、乙烷中混有乙烯,通入氢气在一定条件下反应,使乙烯转化为乙烷 |
| C、硝基苯中混有浓硝酸和浓硫酸,将其倒入浓烧碱溶液中,静置,然后分液 |
| D、乙烷中混有乙炔,通入高锰酸钾酸性溶液洗气除去 |
下列各组物质性质的比较中,正确的是( )
| A、热稳定性:NH3<PH3<H2O |
| B、酸性:H3PO4>H2SO4>HClO4 |
| C、碱性:NaOH>Mg(OH)2>Al(OH)3 |
| D、金属性:Na>Mg>Al |