题目内容
Ⅰ.氮元素可以形成多种化合物.回答以下问题:
(1)基态氮原子的价电子排布图是 .
(2)C、N、O 三种元素第一电离能从大到小的顺序是 .
(3)肼(N2H4)分子可视为NH3 分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物.
①NH3 分子的空间构型是 ;N2H4 分子中氮原子轨道的杂化类型是 .
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)═3N2(g)+4H2O(g)△H=-1038.7kJ?mol-1
若该反应中有4mol N-H 键断裂,则形成的π 键有 mol.
Ⅱ.金属镍在电池、合金、催化剂等方面应用广泛.
(4)第二周期基态原子未成对电子数与Ni 相同且电负性最小的元素是 .
(5)甲醛(H2C=O)在Ni 催化作用下加氢可得甲醇(CH3OH).甲醛分子内C 原子的杂化方式为 .
Ⅲ.氮可以形成多种离子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于 NH4+的性质.
(6)写出N2H62+与碱溶液反应的离子方程式 ;
(7)写出N3-等电子体物质的化学式 ;(一种)
(1)基态氮原子的价电子排布图是
(2)C、N、O 三种元素第一电离能从大到小的顺序是
(3)肼(N2H4)分子可视为NH3 分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物.
①NH3 分子的空间构型是
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)═3N2(g)+4H2O(g)△H=-1038.7kJ?mol-1
若该反应中有4mol N-H 键断裂,则形成的π 键有
Ⅱ.金属镍在电池、合金、催化剂等方面应用广泛.
(4)第二周期基态原子未成对电子数与Ni 相同且电负性最小的元素是
(5)甲醛(H2C=O)在Ni 催化作用下加氢可得甲醇(CH3OH).甲醛分子内C 原子的杂化方式为
Ⅲ.氮可以形成多种离子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于 NH4+的性质.
(6)写出N2H62+与碱溶液反应的离子方程式
(7)写出N3-等电子体物质的化学式
考点:原子核外电子排布,元素电离能、电负性的含义及应用,原子轨道杂化方式及杂化类型判断
专题:原子组成与结构专题,元素周期律与元素周期表专题
分析:(1)N原子核外有7个电子,最外层有5个电子,根据原子轨道中电子的填充规则画出其价电子排布图;
(2)同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA族和第VA族元素的第一电离能大于相邻元素;
(3)①根据价层电子对互斥理论确定分子空间构型和原子的杂化方式;
②根据 N-H的物质的量求出N2H4的物质的量,再求N2的物质的量,1molN2中含有2molπ键;
(4)Ni原子有2个未成对电子,第二周期有2个未成对电子的元素有C、O元素,同一周期,元素的电负性随着原子序数的增大而增大;
(5)根据价层电子对互斥模型判断;
(6)中N2H62+中N的化合价为+4价,N2H62+是由中性分子 N2H4 结合2个质子形成的,相当于故N2H62+相当于二元酸,碱性溶液中反应的离子方程式为N2H62++2OH-=N2H4+2H2O;
(7)含有22个电子的多原子物质有N2O、CO2、CNO-、BeF2、CaH2、C3H4等.
(2)同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA族和第VA族元素的第一电离能大于相邻元素;
(3)①根据价层电子对互斥理论确定分子空间构型和原子的杂化方式;
②根据 N-H的物质的量求出N2H4的物质的量,再求N2的物质的量,1molN2中含有2molπ键;
(4)Ni原子有2个未成对电子,第二周期有2个未成对电子的元素有C、O元素,同一周期,元素的电负性随着原子序数的增大而增大;
(5)根据价层电子对互斥模型判断;
(6)中N2H62+中N的化合价为+4价,N2H62+是由中性分子 N2H4 结合2个质子形成的,相当于故N2H62+相当于二元酸,碱性溶液中反应的离子方程式为N2H62++2OH-=N2H4+2H2O;
(7)含有22个电子的多原子物质有N2O、CO2、CNO-、BeF2、CaH2、C3H4等.
解答:
解:(1)氮原子的电子排布式1s22s22p3,其价层电子排布图为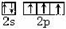 ,故答案为:
,故答案为: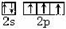 ;
;
(2)C、N、O属于同一周期元素且原子序数依次减小,同一周期元素的第一电离能随着原子序数的增大而增大,但第ⅤA族的大于第ⅥA族的,所以其第一电离能大小顺序是N>O>C,
故答案为:N>O>C;
(3)①NH3分子中氮原子含有3个共价键和一个孤电子对,所以空间构型是三角锥型;N2H4分子中氮原子的加成电子对=3+1=4,含有一个孤电子对,N原子轨道的杂化类型是sp3,
故答案为:三角锥型;sp3;
②反应中有4mol N-H 键断裂,则反应的N2H4为1mol,反应生成的N2为1.5mol,已知1molN2中含有2molπ键,所以形成的π 键有3mol,故答案为:3;
(4)Ni原子有2个未成对电子,第二周期有2个未成对电子的元素是C和O元素,电负性较小的是C元素,故答案为:C;
(5)甲醛(H2C=O)分子内碳原子形成3个σ键,无孤对电子,杂化方式为sp2杂化,故答案为:sp2;
(6)中N2H62+中N的化合价为+4价,N2H62+是由中性分子N2H4结合2个质子形成的,故N2H62+相当于二元酸,故在碱性溶液中反应的离子方程式为N2H62++2OH-=N2H4+2H2O,故答案为:N2H62++2OH-=N2H4+2H2O;
(7)含有22个电子的多原子物质有N2O、CO2、CNO-、BeF2、CaH2、C3H4等,故答案为:N2O.
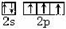 ,故答案为:
,故答案为: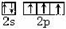 ;
;(2)C、N、O属于同一周期元素且原子序数依次减小,同一周期元素的第一电离能随着原子序数的增大而增大,但第ⅤA族的大于第ⅥA族的,所以其第一电离能大小顺序是N>O>C,
故答案为:N>O>C;
(3)①NH3分子中氮原子含有3个共价键和一个孤电子对,所以空间构型是三角锥型;N2H4分子中氮原子的加成电子对=3+1=4,含有一个孤电子对,N原子轨道的杂化类型是sp3,
故答案为:三角锥型;sp3;
②反应中有4mol N-H 键断裂,则反应的N2H4为1mol,反应生成的N2为1.5mol,已知1molN2中含有2molπ键,所以形成的π 键有3mol,故答案为:3;
(4)Ni原子有2个未成对电子,第二周期有2个未成对电子的元素是C和O元素,电负性较小的是C元素,故答案为:C;
(5)甲醛(H2C=O)分子内碳原子形成3个σ键,无孤对电子,杂化方式为sp2杂化,故答案为:sp2;
(6)中N2H62+中N的化合价为+4价,N2H62+是由中性分子N2H4结合2个质子形成的,故N2H62+相当于二元酸,故在碱性溶液中反应的离子方程式为N2H62++2OH-=N2H4+2H2O,故答案为:N2H62++2OH-=N2H4+2H2O;
(7)含有22个电子的多原子物质有N2O、CO2、CNO-、BeF2、CaH2、C3H4等,故答案为:N2O.
点评:本题考查了电子排布图、第一电离能的比较、电负性的比较、分子空间构型的判断、原子的杂化方式的判断等知识点,题目涉及的知识点较多,综合性较强,难度中等,注意分子空间构型的判断及原子杂化方式的判断是高考的热点.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
某同学在实验室中进行如表实验:
以下结论正确的是( )
| 编号 | I | Ⅱ | Ⅲ |
| 实验 |  |
 |
 |
| 现象 | 没有明显变化,溶液仍为无色 | 有白色沉淀生成,溶液为蓝色 | 有无色气体放出 |
| A、I中混合前后溶液中各离子种类、个数均不变 |
| B、Ⅱ中反应前后溶液中Cu2+、Cl-浓度均未变 |
| C、Ⅱ中BaCl2替换为Ba(NO3)2溶液,发生的离子反应相同 |
| D、Ⅲ中发生的反应属于置换反应,不属于离子反应 |
在实验室中,下列除去杂质的方法正确的是( )
| A、溴苯中混有溴,加入KI溶液,用汽油萃取 |
| B、乙烷中混有乙烯,通入氢气在一定条件下反应,使乙烯转化为乙烷 |
| C、硝基苯中混有浓硝酸和浓硫酸,将其倒入浓烧碱溶液中,静置,然后分液 |
| D、乙烷中混有乙炔,通入高锰酸钾酸性溶液洗气除去 |
