题目内容
下列书写正确的是( )
| A、硫化钠水解:S2-+2H2O?H2S+2OH- |
| B、碳酸钠与醋酸溶液反应:CO32-+2H+=H2O+CO2↑ |
| C、HCO3-的电离:H2O+HCO3-?CO32-+H3O+ |
| D、NaHS在水中的电离:NaHS?Na++HS- HS-?H++S2- |
考点:离子方程式的书写,电离方程式的书写
专题:离子反应专题
分析:A.多元弱酸根离子分步水解;
B.醋酸是弱电解质保留化学式;
C.HCO3-是多元弱酸的酸式根离子电离,电离生成碳酸根离子和水合氢离子;
D.NaHS是强电解质在水中完全电离出钠离子与硫氢根离子.
B.醋酸是弱电解质保留化学式;
C.HCO3-是多元弱酸的酸式根离子电离,电离生成碳酸根离子和水合氢离子;
D.NaHS是强电解质在水中完全电离出钠离子与硫氢根离子.
解答:
解:A.硫化钠水解的离子方程式:S2-+H2O?HS-+OH-;HS-?H++S2-,故A错误;
B.碳酸钠与醋酸溶液反应离子方程式:CO32-+2CH3COOH=H2O+2CH3COO-+CO2↑,故B错误;
C.HCO3-的电离的离子方程式为:H2O+HCO3-?CO32-+H3O+,故C正确;
D.NaHS在水中的电离的离子方程式:NaHS=HS-+Na+,故D错误;
故选:C.
B.碳酸钠与醋酸溶液反应离子方程式:CO32-+2CH3COOH=H2O+2CH3COO-+CO2↑,故B错误;
C.HCO3-的电离的离子方程式为:H2O+HCO3-?CO32-+H3O+,故C正确;
D.NaHS在水中的电离的离子方程式:NaHS=HS-+Na+,故D错误;
故选:C.
点评:本题考查了离子方程式的书写,侧重弱电解质电离和盐类水解的离子方程式书写的考查,明确弱电解质电离、盐类的水解为可逆反应及弱酸根离子水解特点是解题的关键.

练习册系列答案
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
某同学在实验室中进行如表实验:
以下结论正确的是( )
| 编号 | I | Ⅱ | Ⅲ |
| 实验 | 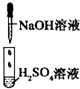 |
 |
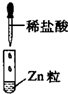 |
| 现象 | 没有明显变化,溶液仍为无色 | 有白色沉淀生成,溶液为蓝色 | 有无色气体放出 |
| A、I中混合前后溶液中各离子种类、个数均不变 |
| B、Ⅱ中反应前后溶液中Cu2+、Cl-浓度均未变 |
| C、Ⅱ中BaCl2替换为Ba(NO3)2溶液,发生的离子反应相同 |
| D、Ⅲ中发生的反应属于置换反应,不属于离子反应 |
下列说法正确的是( )
| A、增大压强,活化分子数增多 |
| B、升高温度,活化分子百分数增大 |
| C、使用催化剂能降低反应热 |
| D、加入反应物,使活化分子百分数增加,化学反应速率增大 |
在周期表中存在对角线规则,据此判断下列物质的性质相似性的是( )
| A、氮和硅 | B、铝和铁 |
| C、铍和铝 | D、铜和金 |