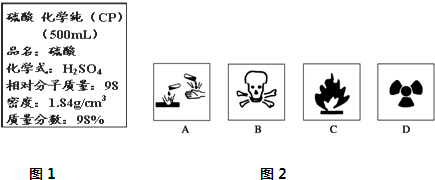
题目内容
 某条件下,在2L密闭容器中发生如下反应:2NO2(g)?2NO(g)+O2(g)△H>0.在三种不同条件下进行,其中NO、O2的起始浓度都为0mol?L-1,实验Ⅰ、Ⅱ反应温度相同,NO2的浓度(mol?L-1)随时间(min)的变化如图所示.
某条件下,在2L密闭容器中发生如下反应:2NO2(g)?2NO(g)+O2(g)△H>0.在三种不同条件下进行,其中NO、O2的起始浓度都为0mol?L-1,实验Ⅰ、Ⅱ反应温度相同,NO2的浓度(mol?L-1)随时间(min)的变化如图所示.请回答下列问题:
(1)请在图中标上对应的反应温度(800℃或850℃).实验Ⅱ隐含的反应条件是
(2)写出该反应的平衡常数表达式:K=
(3)若实验Ⅰ中达到平衡后,再向密闭容器中通入1mol NO2与1mol NO混合气体(保持温度不变),则平衡将
(4)一定条件下NO2与SO2可发生反应,其方程式为NO2(g)+SO2(g)?SO3(g)+NO(g)△H>0,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
A.体系压强保持不变B.混合气体颜色保持不变C.SO2和NO的体积比保持不变D.混合气体的平均相对分子质量保持不变
(5)若改变条件,使平衡常数变大,该反应
A.一定向正反应方向移动B.在平衡移动时,正反应速率先增大后减小
C.一定向逆反应方向移动D.在平衡移动时,逆反应速率先增大后减小.
考点:物质的量或浓度随时间的变化曲线,化学平衡常数的含义,化学平衡状态的判断
专题:化学平衡专题
分析:(1)实验Ⅰ和实验Ⅱ平衡时NO2的浓度相同,但实验Ⅱ反应速率大;
(2)化学平衡常数为生成物浓度系数次幂之积与反应物浓度系数次幂之积的比值;
(3)根据平衡常数和浓度商判断平衡移动;
(4)根据化学平衡状态的特征:逆、定、动、变、等来判断化学反应是否达到平衡;
(5)化学平衡常数只与温度有关,由于该反应为吸热反应,升温,平衡右移,K增大,v(正)、v(逆)均增大.
(2)化学平衡常数为生成物浓度系数次幂之积与反应物浓度系数次幂之积的比值;
(3)根据平衡常数和浓度商判断平衡移动;
(4)根据化学平衡状态的特征:逆、定、动、变、等来判断化学反应是否达到平衡;
(5)化学平衡常数只与温度有关,由于该反应为吸热反应,升温,平衡右移,K增大,v(正)、v(逆)均增大.
解答:
解:(1)由于实验Ⅰ达到平衡所用时间比实验Ⅲ长,所以实验Ⅰ时对应温度为800℃,实验Ⅲ对应温度为850℃.实验Ⅱ和实验Ⅰ比较,达到平衡所用时间短,但平衡不移动,所以实验Ⅱ隐含条件为使用了催化剂,故答案为:使用了催化剂;
(2)化学平衡常数为生成物浓度系数次幂之积与反应物浓度系数次幂之积的比值,故答案为:
;
(3)实验Ⅰ中,平衡时c(NO2)=0.5mol?L-1,c(NO)=0.5mol?L-1,c(O2)=0.25mol?L-1,
即 2NO2(g)?2NO(g)+O2(g)
0.5mol?L-1 0.5mol?L-1 0.25mol?L-1
K=
=0.25.当再加入0.25mol?L-1NO2、0.25mol?L-1NO时,Qc=
=0.25,所以平衡不移动,故答案为:不移动;
(4)A.反应NO2(g)+SO2(g)?SO3(g)+NO(g)是反应前后气体分子数不变的反应,故体系的压强保持不变,故A错误;
B.随着反应的进行,NO2的浓度减小,颜色变浅,故B正确;
C.SO2是反应物,NO是生成物,二者比例保持1:1,即二者浓度不再发生变化,即达到化学平衡状态,故C正确;
D.M=
,反应前后气体质量不变,反应前后气体体积不变,相对分子质量不随化学平衡移动而变化,不能判断是否达到化学平衡状态,故D错误;
故选BC;
(5))化学平衡常数只与温度有关,△H>0,该反应为吸热反应,升温,平衡右移,K增大,v(正)、v(逆)均增大,A、B正确,故答案为:AB.
(2)化学平衡常数为生成物浓度系数次幂之积与反应物浓度系数次幂之积的比值,故答案为:
| c2(NO)?c(O2) |
| c2(NO2) |
(3)实验Ⅰ中,平衡时c(NO2)=0.5mol?L-1,c(NO)=0.5mol?L-1,c(O2)=0.25mol?L-1,
即 2NO2(g)?2NO(g)+O2(g)
0.5mol?L-1 0.5mol?L-1 0.25mol?L-1
K=
| 0.52?0.25 |
| 0.52 |
| (0.5+0.5)2×0.25 |
| (0.5+0.5)2 |
(4)A.反应NO2(g)+SO2(g)?SO3(g)+NO(g)是反应前后气体分子数不变的反应,故体系的压强保持不变,故A错误;
B.随着反应的进行,NO2的浓度减小,颜色变浅,故B正确;
C.SO2是反应物,NO是生成物,二者比例保持1:1,即二者浓度不再发生变化,即达到化学平衡状态,故C正确;
D.M=
| m |
| n |
故选BC;
(5))化学平衡常数只与温度有关,△H>0,该反应为吸热反应,升温,平衡右移,K增大,v(正)、v(逆)均增大,A、B正确,故答案为:AB.
点评:本题考查图象与化学平衡,明确影响化学平衡的因素及图象中量的是解答本题的关键,(3)是学生解答中的难点,注意利用K与Q来分析平衡移动的方法.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
下列化合物中,含有非极性键的离子化合物是( )
①Ba(OH)2 ②H2SO4 ③Na2O2 ④CaCl2.
①Ba(OH)2 ②H2SO4 ③Na2O2 ④CaCl2.
| A、③ | B、①③④ |
| C、③④ | D、①②③④ |
某同学在实验室中进行如表实验:
以下结论正确的是( )
| 编号 | I | Ⅱ | Ⅲ |
| 实验 | 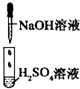 |
 |
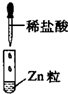 |
| 现象 | 没有明显变化,溶液仍为无色 | 有白色沉淀生成,溶液为蓝色 | 有无色气体放出 |
| A、I中混合前后溶液中各离子种类、个数均不变 |
| B、Ⅱ中反应前后溶液中Cu2+、Cl-浓度均未变 |
| C、Ⅱ中BaCl2替换为Ba(NO3)2溶液,发生的离子反应相同 |
| D、Ⅲ中发生的反应属于置换反应,不属于离子反应 |