题目内容
逻辑推理是化学学习中常用的一种思维方法,以下推理中正确的是
A.单质都是由同种元素组成的,只含一种元素的物质一定是纯净物
B.金属铝排在金属活动性顺序表中氢元素的前面,铝与酸反应一定放出氢气
C.中和反应都有盐和水生成,有盐和水生成的反应都属于中和反应
D.氧化物中都含有氧元素,含氧元素的化合物不一定是氧化物
练习册系列答案
相关题目
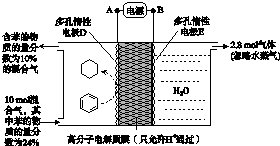
5. 在电解质溶液的导电性实验(装置如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )
在电解质溶液的导电性实验(装置如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )
 在电解质溶液的导电性实验(装置如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )
在电解质溶液的导电性实验(装置如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )| A. | 盐酸中逐滴加入氢氧化钠溶液 | |
| B. | 硫酸铜溶液中逐滴加入氢氧化钡溶液 | |
| C. | 硫酸中逐滴加入氯化钡溶液 | |
| D. | 盐酸中逐滴加入硝酸银溶液 |
6.相同质量的Na、Mg、Al分别与过量的盐酸反应,在相同条件下置换出H2的体积比是( )
| A. | 1:2:3 | B. | 23:12:9 | C. | 9:12:23 | D. | 36:69:92 |
下列各组物质中,物质之间通过一步反应就能实现图示变化的是( )
物质编号 | 物质转化关系 | a | b | c | d |
A |
| N2 | NO2 | NO | HNO3 |
B | Na | Na2O2 | NaOH | NaCl | |
C | Si | SiO2 | H2SiO3 | Na2SiO3 | |
D | Al2O3 | NaAlO2 | Al | Al(OH)3 |


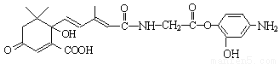 与NaOH溶液反应,最多消耗5molNaOH
与NaOH溶液反应,最多消耗5molNaOH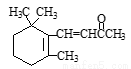 )与1molHBr发生加成反应可得到3种不同产物
)与1molHBr发生加成反应可得到3种不同产物

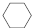 (g)$?_{高温}^{Pt-Sn/Al_{2}O_{3}}$
(g)$?_{高温}^{Pt-Sn/Al_{2}O_{3}}$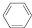 (g)+3H2(g).
(g)+3H2(g).