题目内容
下列分散系中分散质粒子最小的是
A.葡萄糖溶液 B.Fe(OH)3胶体 C.少量植物油和水混合 D.泥水
练习册系列答案
相关题目
10.化学与生活密切相关.下列生活中常见物质的俗名与化学式相对应的是( )
| A. | 小苏打--Na2CO3 | B. | 生石灰--Ca (OH)2 | C. | 甲醛--CH3OH | D. | 烧碱--NaOH |
X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。据此回答下列问题:
(1)L的常见原子组成符号为 ;M在元素周期表中的位置为 ;五种元素的原子半径从大到小的顺序是 (用具体元素符号表示)。
(2)Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的电子式为 ,B的结构式为 。Z和L也能组成原子数目比2∶4的分子C, 已知1 mol 液态C和液态B燃烧时生成无毒无害物质,并释放524.5 kJ的热量,试写出该反应的热化学方程式为 。
(3)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为 ,其最高价氧化物对应的水化物化学式为 。该族2 ~ 5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是 (填字母代号)。
A.+99.7 kJ·mol-1 | B.+29.7 kJ·mol-1 | C.-20.6 kJ·mol-1 | D.-241.8 kJ·mol-1 |
(4)用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R。写出阳极生成R的电极反应式: 。
12.MnO2是-种重要的无机功能材料,工业上从锰结核中制取纯净的MnO2工艺流程如图所示:
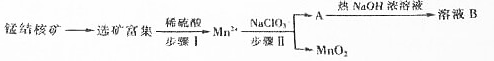
部分难容的电解质浓度积常数(Ksp)如下表:
已知,一定条件下.MnO4-可与Mn2+反应生成MnO2
(1)步骤Ⅱ中消耗0.5molMn2+时,用去1mol•L-1的NaClO3溶液200mL.该反应离子方程式为2ClO3-+5Mn2++4H2O=5MnO2+8H++Cl2↑
(2)已知溶液B的溶质之一可循环用于上述生产,此物质的名称是氯酸钠
(3)MnO2是碱性锌锰电池的正极材料.放电过程产生MnOOH,该电池正极的电极反应式是MnO2+H2O+e-═MnOOH+OH-.如果维持电流强度为5A,电池工作5分钟,理论消耗锌0.5g(已知F=96500C/mol)
(4)向废旧锌锰电池内的混合物(主要成分MnOOH,Zn(OH)2)中加入一定量的稀硫酸和稀草酸(H2C2O4),并不断搅拌至无CO2产生为止,写出MnOOH参与反应的离子方程式为2MnOOH+H2C2O4+2H2SO4=2CO2↑+2MnSO4+4H2O.向所的溶液中滴加高锰酸钾溶液产生黑色沉淀,设计实验证明黑色陈定成分为MnO2取少量黑色固体放入试管中,加入少量浓盐酸并加热,产生黄绿色气体,说明黑色固体为MnO2
(5)用废旧电池的锌皮制作ZnSO4•7H2O的过程中,需除去锌皮中少量的杂质铁,其方法是:加入稀H2SO4和H2O2,铁溶解变为Fe3+,加碱调pH为2.7时,铁刚好沉淀完全(离子浓度小于1×10-5mol•L-1时,即可认为该离子沉淀完全).继续调节pH为6时,锌开始沉淀(假定Zn2+浓度为0.1mol•L-1).若上述过程不加H2O2,其后果和原因是Zn(OH)2、Fe(OH)2的Ksp相近,Zn2+和Fe2+分离不开.
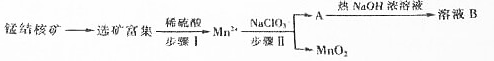
部分难容的电解质浓度积常数(Ksp)如下表:
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
(1)步骤Ⅱ中消耗0.5molMn2+时,用去1mol•L-1的NaClO3溶液200mL.该反应离子方程式为2ClO3-+5Mn2++4H2O=5MnO2+8H++Cl2↑
(2)已知溶液B的溶质之一可循环用于上述生产,此物质的名称是氯酸钠
(3)MnO2是碱性锌锰电池的正极材料.放电过程产生MnOOH,该电池正极的电极反应式是MnO2+H2O+e-═MnOOH+OH-.如果维持电流强度为5A,电池工作5分钟,理论消耗锌0.5g(已知F=96500C/mol)
(4)向废旧锌锰电池内的混合物(主要成分MnOOH,Zn(OH)2)中加入一定量的稀硫酸和稀草酸(H2C2O4),并不断搅拌至无CO2产生为止,写出MnOOH参与反应的离子方程式为2MnOOH+H2C2O4+2H2SO4=2CO2↑+2MnSO4+4H2O.向所的溶液中滴加高锰酸钾溶液产生黑色沉淀,设计实验证明黑色陈定成分为MnO2取少量黑色固体放入试管中,加入少量浓盐酸并加热,产生黄绿色气体,说明黑色固体为MnO2
(5)用废旧电池的锌皮制作ZnSO4•7H2O的过程中,需除去锌皮中少量的杂质铁,其方法是:加入稀H2SO4和H2O2,铁溶解变为Fe3+,加碱调pH为2.7时,铁刚好沉淀完全(离子浓度小于1×10-5mol•L-1时,即可认为该离子沉淀完全).继续调节pH为6时,锌开始沉淀(假定Zn2+浓度为0.1mol•L-1).若上述过程不加H2O2,其后果和原因是Zn(OH)2、Fe(OH)2的Ksp相近,Zn2+和Fe2+分离不开.


 由徐光宪院士发起、院士学子同创的《分子共和国》科普读物最近出版了,全书形象生动地戏说了BF3、TiO2、HCHO、N2O、二茂铁、NH3、HCN、H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星.
由徐光宪院士发起、院士学子同创的《分子共和国》科普读物最近出版了,全书形象生动地戏说了BF3、TiO2、HCHO、N2O、二茂铁、NH3、HCN、H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星.