题目内容
7.华法林是治疗心脑血管疾病的药物,其合成路径如下(部分反应条件略去).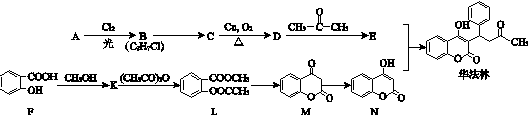
①
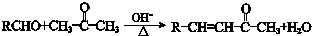
②
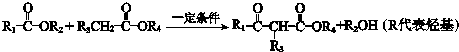
(1)A属于芳香烃,名称是甲苯.
(2)B→C的化学方程式是
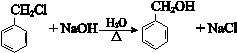 .
.(3)D的含氧官能团名称是醛基.
(4)E的结构简式是
 .
.
分析 D与丙酮发生信息①的反应生成E,N与E反应得到华法林,由N、华法林的结构简式,可推知E为 ,则D为
,则D为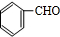 ,C为
,C为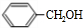 ,B为
,B为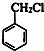 ,A为
,A为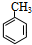 .F与甲醇发生酯化反应生成K为
.F与甲醇发生酯化反应生成K为 ,K与乙酸酐发生取代反应生成L与乙酸,L发生信息②中的反应生成M与甲醇,M发生异构得到N,据此解答.
,K与乙酸酐发生取代反应生成L与乙酸,L发生信息②中的反应生成M与甲醇,M发生异构得到N,据此解答.
解答 解:D与丙酮发生信息①的反应生成E,N与E反应得到华法林,由N、华法林的结构简式,可推知E为 ,则D为
,则D为 ,C为
,C为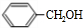 ,B为
,B为 ,A为
,A为 .F与甲醇发生酯化反应生成K为
.F与甲醇发生酯化反应生成K为 ,K与乙酸酐发生取代反应生成L与乙酸,L发生信息②中的反应生成M与甲醇,M发生异构得到N,
,K与乙酸酐发生取代反应生成L与乙酸,L发生信息②中的反应生成M与甲醇,M发生异构得到N,
(1)由上述分析可知,A为 ,名称是:甲苯,故答案为:甲苯;
,名称是:甲苯,故答案为:甲苯;
(2)B→C发生卤代烃的水解反应,反应化学方程式是: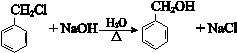
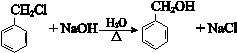
(3)D为 ,含氧官能团名称是:醛基,故答案为:醛基;
,含氧官能团名称是:醛基,故答案为:醛基;
(4)E的结构简式是 ,故答案为:
,故答案为: .
.
点评 本题考查有机物的推断与合成、有机方程式的书写,需要对给予的信息进行利用,较全面地考查学生的有机化学基础知识和逻辑思维能力,也有利于培养学生的自学能力和知识的迁移能力,题目难度中等.

练习册系列答案
相关题目
17.将40℃的饱和NH4Cl溶液冷却至10℃,有NH4Cl固体析出.该过程中保持不变的是( )
| A. | 溶剂的质量 | B. | 溶质的质量分数 | ||
| C. | NH4Cl的溶解度 | D. | 溶液中NH4+的数目 |
18.在25°C时,在水中通入氯化氢气体,当溶液的PH=3时,此时由水电离出的c(H+)是( )
| A. | 10-3mol/L | B. | 10-7 mol/L | C. | 10-11 mol/L | D. | 10-14mol/L |
15.下列说法中,正确的是( )
| A. | 强电解质溶液的导电能力一定比弱电解质强 | |
| B. | 冰醋酸是弱电解质,但液态时不能导电 | |
| C. | 盐酸中加入固体NaCl,因Cl-浓度增大,所以溶液酸性减弱 | |
| D. | 硫酸钠是强电解质,硫酸钡是弱电解质 |
12.下列属于同位素的一组是( )
| A. | ${\;}_{1}^{2}$H、${\;}_{1}^{1}$H | B. | 红磷、白磷 | ||
| C. | Na2O、Na2O2 | D. | ${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca |
19.在化学反应中不仅有物质的变化,还伴随着能量的变化.人们对化学反应的利用也主要表现在这两个方面:制备新物质和获取能量.请填写下列表格.
| 序号 | 各种化学变化 | 制备新物质或能量转化(主要) |
| 示例 | 实验室点燃酒精灯 | 化学能转变为热能 |
| 示例 | 利用氢气和氯气合成盐酸 | 制备新物质 |
| (1) | 从铜矿中提炼铜 | |
| (2) | 冬天,居民烧木炭取暖 | |
| (3) | 镁燃烧制照明弹 | |
| (4) | Pb+PbO2+2H2SO4$\frac{\underline{\;放电\;}}{\;}$2PbSO4+2H2O | |
| (5) | 6nH2O+6nCO2 $→_{叶绿素}^{光}$(C6H12O6)n+6nO2 |
16.下列叙述正确的是( )
| A. | 同周期元素的原子半径以ⅦA族的最大 | |
| B. | 同主族两种元素原子的核外电子数的差值可能为36 | |
| C. | 短周期中次外层电子数是最外层电子数2倍的原子一定是非金属元素的原子 | |
| D. | 科学家在周期表中金属与非金属分界线处找到了优良的催化剂 |
17.常温下,将四种不同的一元酸(用 HA 代表)分别和 NaOH 溶液等体积混合. 两种溶液的物质的量浓度和混合溶液的 pH 如下表所示:
(1)从甲组情况分析,如何判断 HA 是强酸还是弱酸?a=7时,HA是强酸;a>7时,HA是弱酸.
(2)乙组混合溶液中粒子浓度 c(A-)和 c(Na+)的大小关系C. A.前者大 B.后者大 C.两者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+):
(4)分析丁组实验数据,写出混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)=10-3-10-11mol•L-1.
(5)某二元酸(化学式用 H2B 表示)在水中的电离方程式是:
H2B═H++HB-HB-?H++B2-
回答下列问题:
在 0.1mol•L-1 的 Na2B 溶液中,下列粒子浓度关系式正确的是AC.
A.c(B2-)+c(HB-)=0.1mol•L-1
B.c(B2-)+c(HB-)+c(H2B)=0.1mol•L-1
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(H+)=c(OH-)+c(HB-)
| 实验 | HA 物质的量 | NaOH 物质的量 | 混合后溶 |
| 编号 | 浓度/(mol•L-1) | 浓度/(mol•L-1) | 液的 pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.12 | 0.1 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=11 |
(2)乙组混合溶液中粒子浓度 c(A-)和 c(Na+)的大小关系C. A.前者大 B.后者大 C.两者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是c(Na+)>c(A-)>c(OH-)>c(H+):
(4)分析丁组实验数据,写出混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)=10-3-10-11mol•L-1.
(5)某二元酸(化学式用 H2B 表示)在水中的电离方程式是:
H2B═H++HB-HB-?H++B2-
回答下列问题:
在 0.1mol•L-1 的 Na2B 溶液中,下列粒子浓度关系式正确的是AC.
A.c(B2-)+c(HB-)=0.1mol•L-1
B.c(B2-)+c(HB-)+c(H2B)=0.1mol•L-1
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(H+)=c(OH-)+c(HB-)