题目内容
5.已知下列反应:①2BrO3-+Cl2=Br2+2ClO3- ②5Cl2+I2+6H2O=2HIO3+10HCl ③ClO3-+5Cl-+6H+=3Cl2+3H2O判断下列物质氧化能力强弱顺序正确的是( )| A. | ClO3->BrO3->IO3->Cl2 | B. | ClO3->BrO3->Cl2>IO3- | ||
| C. | BrO3->ClO3->Cl2>IO3- | D. | Cl2>BrO3->ClO3->IO3- |
分析 一般来说在自发进行的氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,以此解答该题.
解答 解:①中BrO3-是氧化剂,ClO3-是氧化产物,所以氧化性BrO3->ClO3-,
②中Cl2是氧化剂,HIO3是氧化产物,所以氧化性Cl2>IO3-,
③中ClO3-是氧化剂,是Cl2氧化产物,所以氧化性ClO3->Cl2,
综上得氧化性顺序为BrO3->ClO3->Cl2>IO3-.
故选C.
点评 本题考查了根据方程式来比较氧化性和还原性,为高考考点,解题的关键是根据化合价找出氧化剂、还原剂、氧化产物和还原产物,难度不大.

练习册系列答案
相关题目
15.X、Y、Z、M、Q是中学化学常见的五种元素,原子序数依次增大,其结构或性质信息如表:
(1)Q元素基态原子的电子排布式是:1s22s22p63s23p63d64s2.比Q元素原子序数大3的元素的原子结构示意图为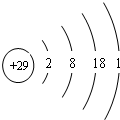 .
.
(2)比较Y元素与氧元素的第一电离能大小顺序N>O;X和Z形成的化合物XZ2为一种液体溶剂,其电子式为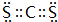 .
.
(3)写出实验室制备M单质的离子方程式:MnO2+2Cl-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+Mn2++2H2O.
(4)M的气态氢化物和氟化氢相比稳定性强的是HF>HCl (写化学式):
| 元素 | 结构或性质信息 |
| X | 其原子最外层电子数是内层电子数的2倍 |
| Y | 基态原子最外层电子排布为nsnnpn+1 |
| Z | 非金属元素,其单质为固体,在氧气中燃烧时有明亮的蓝紫色火焰 |
| M | 单质在常温、常压下是气体.基态原子的M层上有1个未成对的p电子 |
| Q | 其与X形成的合金为目前用量最多的金属材料 |
 .
.(2)比较Y元素与氧元素的第一电离能大小顺序N>O;X和Z形成的化合物XZ2为一种液体溶剂,其电子式为
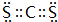 .
.(3)写出实验室制备M单质的离子方程式:MnO2+2Cl-+4H+$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+Mn2++2H2O.
(4)M的气态氢化物和氟化氢相比稳定性强的是HF>HCl (写化学式):
16.下列有关现在的长式元素周期表的判断中正确的是( )
| A. | 从左向右数第七纵行是ⅦA族 | |
| B. | 从左向右数第十一纵行是ⅠB族 | |
| C. | ⅠA族全部是金属元素 | |
| D. | 第ⅦA族元素从上到下,其氢化物的稳定性逐渐增强 |
13.下列叙述不正确的是( )
| A. | 工业上电解饱和食盐水的阳极反应为:2Cl--2e-═Cl2↑ | |
| B. | 船底镶嵌锌块,锌作负极,以防船体被腐蚀 | |
| C. | 钢铁吸氧腐蚀的正极反应为:O2+2H2O+4e-═4OH- | |
| D. | 铁表面镀锌,铁作阳极 |
10.下列物质属于纯净物的是( )
| A. | 食盐水 | B. | 干冰 | C. | 氯水 | D. | 浓硝酸 |
17.将40℃的饱和NH4Cl溶液冷却至10℃,有NH4Cl固体析出.该过程中保持不变的是( )
| A. | 溶剂的质量 | B. | 溶质的质量分数 | ||
| C. | NH4Cl的溶解度 | D. | 溶液中NH4+的数目 |
14.某原电池的总反应离子方程式为2Fe3++Fe═3Fe2+,不能实现该反应的原电池是( )
| A. | 正极为Fe、负极为Fe,电解质溶液为FeCl3溶液 | |
| B. | 正极为Ag、负极为Fe,电解质溶液为CuSO4溶液 | |
| C. | 正极为Fe、负极为Zn,电解质溶液为Fe2(SO4)3溶液 | |
| D. | 正极为C、负极为Fe,电解质溶液为Fe(NO3)3溶液 |
15.下列说法中,正确的是( )
| A. | 强电解质溶液的导电能力一定比弱电解质强 | |
| B. | 冰醋酸是弱电解质,但液态时不能导电 | |
| C. | 盐酸中加入固体NaCl,因Cl-浓度增大,所以溶液酸性减弱 | |
| D. | 硫酸钠是强电解质,硫酸钡是弱电解质 |