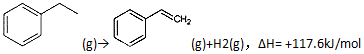题目内容
1.取一定量的KHCO3、K2CO3、和K2SO4的混合物与250ml 2.00mo1•L-1过量盐酸反应,生成2.016LCO2(标准状况),然后加入300ml 1.00mo1•L-1Ba(OH)2溶液,得到沉淀的质量为3.495g,溶液中过量的碱用250.00ml,1.00mo1•L-1盐酸恰好完全中和.(所得数据保留到小数点后两位)求:(1)m(KHCO3)=3.00g;
(2)m(K2CO3)=8.28g;
(3)m(K2SO4)=2.61g.
分析 生成的2.33g沉淀为硫酸钡,根据硫酸根离子守恒可计算出原混合物中K2SO4的物质的量、质量;根据消耗的盐酸、氢氧化钡的物质的量计算出KHCO3、K2CO3消耗的HCl的物质的量,然后根据生成的二氧化碳、消耗的HCl的量分别列式计算出KHCO3、K2CO3的物质的量及质量.
解答 解:设混合物中KHCO3、K2CO3的物质的量分别为x和y,反应中放出的CO2物质的量为:$\frac{2.016L}{22.4L/mol}$=0.090mol,
根据碳原子守恒可知:①x+y=0.09mol,
与K2CO3、KHCO3反应的HCl的物质的量为:2.0mol/L×0.25L+1mol/L×0.25L-1mol/L×0.3L×2=0.15mol,
则:②2x+y=0.15mol,
联立①②解得:x=0.06mol、y=0.03mol,
即:混合物中含有0.03molKHCO3,0.06molK2CO3,
(1)m(KHCO3)=100g/mol×0.03mol=3.00g,
故答案为:3.00;
(2)m(K2CO3)=138g/mol×0.06mol=8.28g,
故答案为:8.28;
(3)加入300ml 1.00mo1•L-1Ba(OH)2溶液溶液后生成的沉淀为硫酸钡,硫酸钡的物质的量为:$\frac{3.495g}{233g/mol}$=0.015mol,根据硫酸根离子守恒可知:混合物中K2SO4的质量为:m(K2SO4)=0.015mol×174g/mol=2.61g,
故答案为:2.61.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握物质的量与摩尔质量、气体摩尔体积、物质的量浓度等之间的关系,试题培养了学生的化学计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.化学与人类生活、生产息息相关,下列说法错误的是( )
| A. | CuSO4具有氧化性,因此用其制成的波尔多液可用作杀菌剂 | |
| B. | 回收的地沟油可以用来制造肥皂、提取甘油或生产生物柴油 | |
| C. | 绿色化学的核心是应用化学原理从源头上减少和消除工业生产对环境的污染 | |
| D. | 纤雏素属于多糖,但不是人类的营养物质 |
12.下列与有机物结构、性质相关的叙述错误的是( )
| A. | 乙醛和丙烯醛( )不是同系物,但它们与H2充分反应后的产物是同系物 )不是同系物,但它们与H2充分反应后的产物是同系物 | |
| B. | 一分子β-月桂烯( )与两分子溴发生加成反应的产物(只考虑位置异构)理论上最多有3种 )与两分子溴发生加成反应的产物(只考虑位置异构)理论上最多有3种 | |
| C. | 用甘氨酸( )和丙氨酸( )和丙氨酸( )缩合最多可形成4种二肽 )缩合最多可形成4种二肽 | |
| D. |  和 和  都既能与NaOH溶液反应,能与溴水反应,但与两种试剂反应的原因都不完全相同 都既能与NaOH溶液反应,能与溴水反应,但与两种试剂反应的原因都不完全相同 |
9.下列叙述不正确的是( )
| A. | 10ml质量分数为98%的H2SO4,用10ml水稀释后,H2SO4的质量分数大于49% | |
| B. | 配制0.1mol/L的Na2CO3溶液480mL,需用500mL容量瓶 | |
| C. | 制备Fe(OH)3胶体时,将饱和FeCl3溶液滴入沸水中,边加热边搅拌,直到得到红褐色溶液 | |
| D. | 向2等份不饱和的烧碱溶液中分别加入一定量的Na2O2、和Na2O,使溶液均恰好饱和,则加入的Na2O2与Na2O的物质的量之比等于1:1(保持温度不变) |
16.在一个容积固定的反应容器中有一可左右滑动的密封隔板,将反应容器分甲、乙两室,甲室充入的是氢气与氯气,共2mol,乙室充入的是一氧化碳与氧气也共2mol,在一定条件下充分反应恢复到起始状态,反应前后变化如图所示:则起始时乙中一氧化碳与氧气的体积比可能为( )
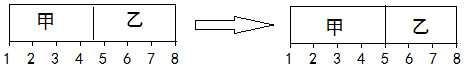

| A. | 1:2 | B. | 4:3 | C. | 2:1 | D. | 3:1 |
13.下列各组物质含有的化学键类型完全相同的是( )
| A. | HBr、CO2、NH3 | B. | Na2O、Na2O2、Na2S | C. | NaCl、HCl、H2O | D. | NaOH、CaCl2 |
10.下列物质分类正确的是( )
| A. | SO2、SiO2、P2O5均为酸性氧化物 | |
| B. | 稀豆浆、硅酸、氯化铁溶液均为胶体 | |
| C. | 酒精、冰醋酸、草酸钾均为电解质 | |
| D. | NH4SCN、SiO2、NH3•H2O均为共价化合物 |