题目内容
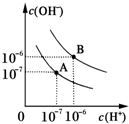 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示:(1)则25℃时水的电离平衡曲线应为
(2)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为
(3)曲线B对应温度下,pH=2的HCl溶液和pH=10的某BOH溶液等体积混合后,混合溶液的pH=8.请分析其原因:
考点:离子积常数,酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:(1)水的电离是吸热过程,降低温度抑制水电离,导致水中c(H+)、c(OH-)都减小;
(2)根据溶液的pH计算出溶液中氢离子、氢氧根离子浓度,再列式计算出氢氧化钠溶液和硫酸溶液的体积;
(3)pH=3的盐酸溶液和pH=9的某碱溶液等体积混合后,氢离子和氢氧根离子恰好反应,根据盐的性质分析.
(2)根据溶液的pH计算出溶液中氢离子、氢氧根离子浓度,再列式计算出氢氧化钠溶液和硫酸溶液的体积;
(3)pH=3的盐酸溶液和pH=9的某碱溶液等体积混合后,氢离子和氢氧根离子恰好反应,根据盐的性质分析.
解答:
解:(1)水的电离是吸热过程,升高温度,使水的电离程度增大,当温度升高时,促进水的电离,水的离子积增大,水中氢离子、氢氧根离子浓度都增大,水的pH减小,但溶液仍然呈中性;
故答案为:A;水的电离是吸热过程,温度低时,电离程度小,c(H+)、c(OH-)小;
(2)25℃时所得混合溶液的pH=7,溶液呈中性即酸碱恰好中和,即n(OH-)=n(H+),则V(NaOH)?10-5 mol?L-1=V(H2SO4)?10-4 mol?L-1,得V(NaOH):V(H2SO4)=10:1,故答案为:10:1;
(3)曲线B对应温度下,pH=2的盐酸溶液和pH=10的某BOH溶液等体积混合后,氢离子和氢氧根离子恰好反应,如果碱是强碱,则盐溶液呈中性,实际上溶液呈碱性,则碱为弱碱,生成强酸弱碱盐水解呈碱性,中和后混合溶液中还剩余较多的弱碱分子,可继续电离出OH-,使溶液呈碱性,
故答案为:BOH为弱碱,c(BOH)?c(HCl),等体积混合两溶液时,BOH过量,反应后溶液呈碱性.
故答案为:A;水的电离是吸热过程,温度低时,电离程度小,c(H+)、c(OH-)小;
(2)25℃时所得混合溶液的pH=7,溶液呈中性即酸碱恰好中和,即n(OH-)=n(H+),则V(NaOH)?10-5 mol?L-1=V(H2SO4)?10-4 mol?L-1,得V(NaOH):V(H2SO4)=10:1,故答案为:10:1;
(3)曲线B对应温度下,pH=2的盐酸溶液和pH=10的某BOH溶液等体积混合后,氢离子和氢氧根离子恰好反应,如果碱是强碱,则盐溶液呈中性,实际上溶液呈碱性,则碱为弱碱,生成强酸弱碱盐水解呈碱性,中和后混合溶液中还剩余较多的弱碱分子,可继续电离出OH-,使溶液呈碱性,
故答案为:BOH为弱碱,c(BOH)?c(HCl),等体积混合两溶液时,BOH过量,反应后溶液呈碱性.
点评:本题考查水的电离和酸、碱混合的pH计算问题,难度较大,注意温度不同而使水的离子积常数不同是解本题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列有关说法正确的是( )
| A、反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0 | ||
| B、所有的化学反应都需要一定的活化能来推动 | ||
C、CH3COOH 溶液加水稀释后,溶液中
| ||
| D、Na2CO3溶液中加入少量Ca(OH)2 固体,CO32-水解程度减小,溶液的pH 减小 |
MgAgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为:2AgCl+Mg═Mg2++2Ag+2Cl-.有关该电池的说法正确的是( )
| A、可用于海上照明供电 |
| B、负极反应为AgCl+e-═Ag+Cl- |
| C、Mg为电池的正极 |
| D、AgCl为阳极,发生了氧化反应 |
根据下面三个化学方程式判断有关物质的性质比较正确的是( )
①I2+SO2+2H2O=H2SO4+2HI
②2FeCl2+Cl2=2FeCl3
③2FeCl3+2HI=2FeCl2+2HCl+I2.
①I2+SO2+2H2O=H2SO4+2HI
②2FeCl2+Cl2=2FeCl3
③2FeCl3+2HI=2FeCl2+2HCl+I2.
| A、氧化性:I2>H2SO4>Cl2>Fe3+ |
| B、还原性:Cl->Fe2+>SO2>I- |
| C、氧化性:Cl2>Fe3+>I2>H2SO4 |
| D、还原性:SO2>Fe2+>I->Cl- |
下列物质中,物质的量为0.5mol的是( )
| A、27g H2O |
| B、标准状况下,33.6L CO2 |
| C、6.02×1023个O2分子 |
| D、含1mol 氧原子的SO2 |
 如图中A~H均为中学化学中常见的物质,它们之间有如下转化关系.其中C均为金属单质,H的焰色反应呈黄色,在通常状况下E跟NaOH或盐酸均可以发生反应.(反应过程中生成的水及其他产物已略去)请回答以下问题.
如图中A~H均为中学化学中常见的物质,它们之间有如下转化关系.其中C均为金属单质,H的焰色反应呈黄色,在通常状况下E跟NaOH或盐酸均可以发生反应.(反应过程中生成的水及其他产物已略去)请回答以下问题. T℃时,在某容积恒为2L密闭容器中充入2molN2、4molH2,在催化剂辅助下发生反应:N2(g)+3H2(g)?2NH3(g)△H=-92.0kJ/mol.t0时刻,建立平衡后,测得生成NH3的量为2mol;从t1时刻开始,改变反应的一个条件,体系中反应速率随时间变化的情况,如图所示.
T℃时,在某容积恒为2L密闭容器中充入2molN2、4molH2,在催化剂辅助下发生反应:N2(g)+3H2(g)?2NH3(g)△H=-92.0kJ/mol.t0时刻,建立平衡后,测得生成NH3的量为2mol;从t1时刻开始,改变反应的一个条件,体系中反应速率随时间变化的情况,如图所示.


