题目内容
 T℃时,在某容积恒为2L密闭容器中充入2molN2、4molH2,在催化剂辅助下发生反应:N2(g)+3H2(g)?2NH3(g)△H=-92.0kJ/mol.t0时刻,建立平衡后,测得生成NH3的量为2mol;从t1时刻开始,改变反应的一个条件,体系中反应速率随时间变化的情况,如图所示.
T℃时,在某容积恒为2L密闭容器中充入2molN2、4molH2,在催化剂辅助下发生反应:N2(g)+3H2(g)?2NH3(g)△H=-92.0kJ/mol.t0时刻,建立平衡后,测得生成NH3的量为2mol;从t1时刻开始,改变反应的一个条件,体系中反应速率随时间变化的情况,如图所示.试回答下列问题:
(1)T℃时,t0时刻,建立平衡后N2的转化率为:
(2)t1时刻,改变的外界条件是
(3)t4时刻,改变的外界条件是
(3)平衡常数K(t5~t6)
(4)T℃时,建立平衡后,向容器中加入2molN2和2molNH3,则此时 v正
考点:化学反应速率与化学平衡图象的综合应用
专题:化学平衡专题
分析:(1)转化率为已转化的反应物浓度与起始浓度的百分比;化学平衡常数为平衡时生成物浓度系数次幂与反应物浓度系数次幂乘积的比值;
(2)根据t1时刻,正逆反应速率变化判断;
(3)根据t4时刻,正逆反应速率变化判断;
(4)温度相同,化学平衡常数相同;
(5)根据浓度商和化学平衡常数比较,判断化学平衡移动方向.
(2)根据t1时刻,正逆反应速率变化判断;
(3)根据t4时刻,正逆反应速率变化判断;
(4)温度相同,化学平衡常数相同;
(5)根据浓度商和化学平衡常数比较,判断化学平衡移动方向.
解答:
解:(1)某容积恒为2L密闭容器中充入2molN2、4molH2,则二者起始浓度分别为1mol/L、2mol/L,由于生成NH3的量为2mol,平衡时浓度为1mol/L,即N2和lH2转化的浓度分别为:1mol/L×
=0.5mol/L、1mol/L×
=1.5mol/L,平衡时浓度分别为:1mol/L-0.5mol/L=0.5mol/L、2mol/L-1.5mol/L=0.5mol/L,则N2的转化率为:
=50%;化学平衡常数为:
=16,
故答案为:50%;16;
(2)t1时刻到t2时刻,化学平衡向逆反应方向移动,且正逆反应速率均增大,不难判断改变的条件为升高温度;故答案为:升高温度;
(3)t4时刻,正逆反应速率都减小,并且平衡向逆向移动,所以改变的条件为减小压强,故答案为:减小压强;
(4)t5~t6,平衡不发生移动,t6~t7则仅正反应速率增大,则增大反应物浓度,温度没变,t7~t8,平衡不发生移动,温度也没变,所以化学平衡常数不变,
故答案为:=;t6时刻改变的条件是增大反应物的浓度,温度没有改变;
(5)T℃时,向容器中加入2molN2和2molNH3,则N2和NH3浓度分别为:0.5mol/L+
=1.5mol/L、1mol/L+
=2mol/L,浓度商为:
=21.3>16,化学平衡向逆反应方向移动,故v正<v逆,故答案为:<.
| 1 |
| 2 |
| 3 |
| 2 |
| 0.5mol/L |
| 1mol/L |
| (1mol/L) 2 |
| (0.5mol/L)?(0.5mol/L) 3 |
故答案为:50%;16;
(2)t1时刻到t2时刻,化学平衡向逆反应方向移动,且正逆反应速率均增大,不难判断改变的条件为升高温度;故答案为:升高温度;
(3)t4时刻,正逆反应速率都减小,并且平衡向逆向移动,所以改变的条件为减小压强,故答案为:减小压强;
(4)t5~t6,平衡不发生移动,t6~t7则仅正反应速率增大,则增大反应物浓度,温度没变,t7~t8,平衡不发生移动,温度也没变,所以化学平衡常数不变,
故答案为:=;t6时刻改变的条件是增大反应物的浓度,温度没有改变;
(5)T℃时,向容器中加入2molN2和2molNH3,则N2和NH3浓度分别为:0.5mol/L+
| 2mol |
| 2L |
| 2mol |
| 2L |
| (2mol/L)2 |
| 1.5mol/L?(0.5mol/L) 3 |
点评:本题考查化学平衡状态判断、化学平衡移动、平衡转化率和化学平衡常数,难度不大,能够熟练掌握化学平衡常数的应用.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
实验室里不同化学试剂的保存方法不尽相同,①NaOH溶液 ②大理石 ③NaCl溶液 ④硝酸4种试剂通常各自存放在如图所示的玻璃试剂瓶中.按照试剂瓶的顺序存放试剂序号正确的是( )
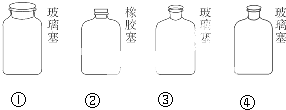

| A、①②③④ | B、②①④③ |
| C、②③④① | D、②①③④ |
下列有关反应热的叙述正确的是( )
| A、已知2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol |
| B、C(石墨,s)═C(金刚石,s)△H>0,所以金刚石比石墨稳定 |
| C、已知碳的燃烧热为ykJ/mol,当7.2g的碳在12.8g的氧气中燃烧,至反应物耗尽并放出xkJ的热量,则可求出1mol碳与氧气反应生成1mol一氧化碳气体时△H=-(2.5x-0.5y)kJ/mol |
| D、已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 |
分别取1g左右某脂肪酸(M<300):①与含I2为2.7g的碘的CCl4溶液完全加成;②与含0.2gKOH的溶液所中和.由此推测该脂肪酸的准确相对分子质量可能为( )
| A、290 | B、282 |
| C、280 | D、278 |


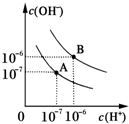 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示: