题目内容
现有分别放置如图装置(都盛有稀H2SO4溶液)中的四个相同的纯锌片,腐蚀最慢的是( )
A、 |
B、 |
C、 |
D、 |
考点:金属的电化学腐蚀与防护
专题:电化学专题
分析:电化学腐蚀较化学腐蚀快,金属得到保护时,腐蚀较慢,作原电池正极和电解池阴极的金属被保护,腐蚀快慢为:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护腐蚀措施的腐蚀.
解答:
解:A中发生化学腐蚀,B中锌作原电池正极,Zn被保护,C中锌作负极,发生电化学腐蚀,加快锌的腐蚀,D中锌作电解池阴极,不易被腐蚀,
腐蚀快慢为:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护腐蚀措施的腐蚀,
则腐蚀速率由快到慢的顺序为CABD,
故选D.
腐蚀快慢为:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护腐蚀措施的腐蚀,
则腐蚀速率由快到慢的顺序为CABD,
故选D.
点评:本题考查不同条件下金属腐蚀的快慢,明确腐蚀快慢为:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护腐蚀措施的腐蚀即可解答,难度不大.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案
相关题目
化学反应N2+3H2?2NH3的能量变化如图所示,该反应的热化学方程式是( )


| A、N2(g)+3H2(g)?2NH3(l)△H=2(a-b-c)kJ/mol |
| B、N2(g)+3H2(g)?2NH3(g)△H=2(b-a)kJ/mol |
| C、0.5N2(g)+1.5H2(g)?NH3(l)△H=(b+c-a)kJ/mol |
| D、0.5N2(g)+1.5H2(g)?NH3(g)△H=(a+b)kJ/mol |
下列离子方程式中,属于水解反应的是( )
| A、HCOOH+H2O?HCOO-+H3O+ |
| B、CO2+H2O?H2CO3 |
| C、CO32-+H2O?HCO3-+OH- |
| D、HCO3-+H2O?CO32-+H3O+ |
下列各组离子能在溶液中大量共存的是( )
| A、Ag+、Ba2+、Cl- |
| B、Na+、HCO3-、OH- |
| C、NH4+、SO42-、NO3- |
| D、K+、OH-、Fe3+ |
下列物质中,属于酸性氧化物但不溶于水的是( )
| A、Al2O3 |
| B、CO2 |
| C、SO3 |
| D、SiO2 |
在标准状况下,1.12L的某气态单质质量为2.4克,若组成此单质的元素相对原子质量为16,则此单质的相对分子质量及一个分子中含该原子的个数为( )
| A、16和1 | B、32和2 |
| C、48和3 | D、64和4 |
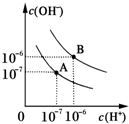 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示: