题目内容
下列有关说法正确的是( )
| A、反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0 | ||
| B、所有的化学反应都需要一定的活化能来推动 | ||
C、CH3COOH 溶液加水稀释后,溶液中
| ||
| D、Na2CO3溶液中加入少量Ca(OH)2 固体,CO32-水解程度减小,溶液的pH 减小 |
考点:弱电解质在水溶液中的电离平衡,焓变和熵变,影响盐类水解程度的主要因素
专题:
分析:A、△H-T△S<0的反应可以自发进行;
B、有的化学反应不需要活化能;
C、醋酸加水稀释促进电离,醋酸分子物质的量减小,醋酸根离子物质的量增大;
D、Na2CO3溶液中加入少量Ca(OH)2 固体,其pH增大.
B、有的化学反应不需要活化能;
C、醋酸加水稀释促进电离,醋酸分子物质的量减小,醋酸根离子物质的量增大;
D、Na2CO3溶液中加入少量Ca(OH)2 固体,其pH增大.
解答:
解:A、该反应△S<0,若能够自发进行,必须△H<0,故A正确;
B、大部分热反应都需要活化能的推动,但是光反应就不需要,故B错误;
C、醋酸加水稀释促进电离,醋酸分子物质的量减小,醋酸根离子物质的量增大,所以
减小,故C错误;
D、Na2CO3溶液中加入少量Ca(OH)2 固体,生成NaOH,溶液pH增大,故D错误;
故选A.
B、大部分热反应都需要活化能的推动,但是光反应就不需要,故B错误;
C、醋酸加水稀释促进电离,醋酸分子物质的量减小,醋酸根离子物质的量增大,所以
| c(CH3COOH) |
| c(CH3COO-) |
D、Na2CO3溶液中加入少量Ca(OH)2 固体,生成NaOH,溶液pH增大,故D错误;
故选A.
点评:本题考查了反应自发进行的条件、反应的活化能、弱电解质的电离平衡的移动、盐类水解,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
广州地区的自来水是采用氯气消毒的,为了检验Cl-的存在,最好选用下列物质中的( )
| A、石蕊溶液 |
| B、四氯化碳 |
| C、氢氧化钠溶液 |
| D、稀硝酸和硝酸银溶液 |
惰性电极电解下列物质的溶液,电解一段时间,阴极质量增加,电解液的pH下降的是( )
| A、CuSO4 |
| B、NaCl |
| C、NaOH |
| D、H2SO4 |
下列离子方程式中,属于水解反应的是( )
| A、HCOOH+H2O?HCOO-+H3O+ |
| B、CO2+H2O?H2CO3 |
| C、CO32-+H2O?HCO3-+OH- |
| D、HCO3-+H2O?CO32-+H3O+ |
下列各组离子能在溶液中大量共存的是( )
| A、Ag+、Ba2+、Cl- |
| B、Na+、HCO3-、OH- |
| C、NH4+、SO42-、NO3- |
| D、K+、OH-、Fe3+ |
下列溶液中H+浓度为0.01mol/L的是( )
| A、0.01mol/L的CH3COOH |
| B、0.01mol/LNaHSO4 |
| C、0.01mol/LNaHCO3 |
| D、0.005mol/LH2SO3 |
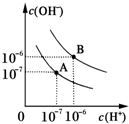 已知水在25℃和95℃时,其电离平衡曲线如图所示:
已知水在25℃和95℃时,其电离平衡曲线如图所示: