题目内容
3.铝热反应可以用于还原金属,现在将27g铝粉与60g氧化铜组成的混合物放在真空反应釜中加热发生铝热反应,充分反应后所得的固体中含有紫红色的固体.(1)所得固体中含有的各物质的物质的量分别是多少?
(2)将所得固体置于足量的4mol•L-1氢氧化钠溶液中,收集到的气体在标准状况下的体积是多少?
分析 (1)据2Al+3CuO$\frac{\underline{\;高温\;}}{\;}$Al2O3+3Cu,进行计算;
(2)据2Al+2NaOH+2H2O=2NaAlO2+3H2↑,进行计算;
解答 解:(1)2Al+3CuO$\frac{\underline{\;高温\;}}{\;}$Al2O3+3Cu,注意方程式计算时应该以不足的作为计算对象,
54 240 102 192
13.5 60 25.5 48
则:m(Al)=27-13.5=13.5g,m(Al2O3)=25.5g,m(Cu)=48g,
答:固体中含有铝的质量13.5g,氧化铝的质量25.5g,铜的质量为48g.
(2)2Al+2NaOH+2H2O=2NaAlO2+3H2↑
54 67.2
13.5 16.8
则:V(H2)=16.8L
答:收集到的气体在标准状况下的体积是16.8L.
点评 正确书写方程式是本题解题的关键,并且注意在化学方程式中应该以不足的作为计算对象,本题较为简单.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案
相关题目
13.已知还原性:SO32->I-.向含有a mol KI和a mol K2SO3的混合液中通入b mol Cl2充分反应(不考虑Cl2与I2之间的反应).下列说法错误的是( )
| A. | 当a≥b时,发生的离子反应为SO32-+Cl2+H2O=SO42-+2H++2Cl- | |
| B. | 当5a=4b时,发生的离子反应为4SO32-+2I-+5Cl2+4H2O=4SO42-+I2+8H++10Cl- | |
| C. | 当a≤b≤$\frac{3}{2}$a时,反应中转移电子的物质的量n(e-)为a mol≤n(e-)≤3a mol | |
| D. | 当a<b<$\frac{3}{2}$a时,溶液中SO42-、I-与Cl-的物质的量之比为a:(3a-2b):2b |
8.下列有关热化学方程式的叙述中,正确的是( )
| A. | 含20.0gNaOH的稀溶液与足量稀硫酸完全中和,放出28.7kJ的热量,则表示中和热的热化学方程式为2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(1)△H=-114.8kJ/mol | |
| B. | 已知热化学方程式:SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ | |
| C. | 已知2H2(g)+O2(g)═2H2O(g);△H=-483.6kJ/mol,则H2的燃烧热为241.8kJ/mol | |
| D. | 已知H+(aq)+OH-(aq)═H2O(1)△H=-57.31kJ•mol-1,故Ba2+(aq)+H+(aq)+OH-(aq)+SO42-(aq)═H2O(1)+BaSO4(s)△H<-57.31kJ•mol-1 |
15.O3在水中易分解生成O2,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示.已知:O3的起始浓度为0.02mol•L-1.
(1)pH增大能加速(填“加速”或“减缓”)O3分解,其中对O3分解起催化作用的是OH-(填“OH-”或“H+”).
(2)在30℃、pH=5.0条件下,O3的分解速率为2.00×10-4 mol•L-1•min-1,O2的浓度为0.015mol/L.
(3)据表中的递变规律,推测O3在下列条件下分解速率的关系:Ⅰ<(填“>”“<”或“=”)Ⅱ.
Ⅰ.40℃,pH=3.0
Ⅱ.30℃,pH=7.0.
| pH t/min T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 300 | 230 | 169 | 58 |
| 30 | 158 | 108 | 50 | 15 |
| 50 | 31 | 26 | 15 | 7 |
(2)在30℃、pH=5.0条件下,O3的分解速率为2.00×10-4 mol•L-1•min-1,O2的浓度为0.015mol/L.
(3)据表中的递变规律,推测O3在下列条件下分解速率的关系:Ⅰ<(填“>”“<”或“=”)Ⅱ.
Ⅰ.40℃,pH=3.0
Ⅱ.30℃,pH=7.0.
12.关于下列各图的叙述,正确的是( )
| A. | 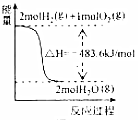 表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6kJ•mol-1 | |
| B. | 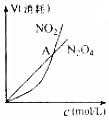 表示恒温恒容条件下发生的可逆反应2NO2(g)?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| C. | 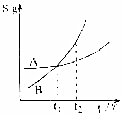 表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数A=B | |
| D. | 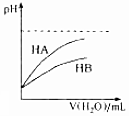 表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH大于NaB溶液 |
13.下列关于铯(Cs)及其化合物的性质的说法中,正确的是( )
| A. | 金属铯的密度比金属钠小 | B. | 金属铯的熔点比金属钠高 | ||
| C. | Cs与H2O能剧烈反应,甚至发生爆炸 | D. | 碳酸铯难溶于水 |