题目内容
5.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )| A. | 澄清透明的溶液中:Na+、K+、MnO4-、NO3- | |
| B. | pH=13的溶液中:Na+、K+、SO42-、HCO3- | |
| C. | 0.1 mol•L-1 NaClO溶液中:K+、Na+、NO3-、I- | |
| D. | 0.1 mol•L-1 FeCl3溶液中:Na+、NH4+、SCN-、SO42- |
分析 A.离子之间不发生任何反应;
B.pH=13的溶液呈碱性;
C.与ClO-发生反应的离子不能大量共存;
D.与Fe3+反应的离子不能大量共存.
解答 解:A.离子之间不发生任何反应,可大量共存,故A正确;
B.pH=13的溶液呈碱性,HCO3-不能大量共存,故B错误;
C.I-与ClO-发生反应二不能大量共存;
D.SCN-与Fe3+反应而不能大量共存,个uDcw.
故选A.
点评 本题考查离子共存问题,为高考常见题型和高频考点,侧重于学生的分析能力以及元素化合物知识的综合理解和运用的考查,注意把握题目要求以及常见离子的性质和反应类型的判断,答题时注意题给信息,难度不大.

练习册系列答案
相关题目
16.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:Mg2+、Al3+、NO3-、Cl- | |
| B. | 使pH试纸显蓝色的溶液中:NH4+、NO3-、SO42-、Na+ | |
| C. | 由水电离的c(H+)=1×10-14mol•L-1的溶液中:Mg2+、K+、Cl-、NO3- | |
| D. | pH=0的溶液中:K+、Fe3+、SO42-、SCN- |
20.醋酸镍[(CH3COO)2Ni]是一种重要的化工原料,一种以含镍废料(含 NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下:
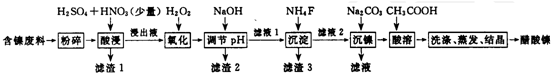
相关离子生成氢氧化物的pH和相关物质的溶解性如表:
(1)调节pH步骤中,溶液pH的调节范围是5.0≤pH<6.7.
(2)滤液1和滤液3主取成分的化学式分別是SiO2、CaSO4、CaF2.
(3)写出氧化步骤中加入H2O2发生反应的离子方程式2Fe2++H2O2+2H+═2Fe3++2H2O.
(4)酸浸过程中,1mol NiS失去6NA个电子,同时生成两种无色有毒气体.写出该反应的化学方程式NiS+H2SO4+2HNO3═NiSO4+SO2↑+2NO↑+2H2O.
(5)沉镍过程中,若c(Ni2+)=2.0mol•L-1,欲使100ml该滤液中的Ni2+沉淀物完全,[c(Ni2+)≤10-5mol•L-1],则需要加人Na2CO3固体的质量最少为1038.8g(保留小数点后1位有效数字)
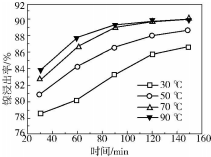
(6)保持其他条件不变,在不同温度下对含镍废料进行酸浸.酸浸出率随时间变化如图.酸浸的最佳温度与时间分别为70℃、120min.

相关离子生成氢氧化物的pH和相关物质的溶解性如表:
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH | 物质 | 20℃时溶解性(H2O) | |
| Fe3+ | 1.1 | 3.2 | CaS04 | 微溶 | |
| Fe2+ | 5.8 | 8.8 | NiF | 可溶 | |
| Al3+ | 3.0 | 5.0 | CaF2 | 难溶 | |
| Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=9.6×10-4 |
(2)滤液1和滤液3主取成分的化学式分別是SiO2、CaSO4、CaF2.
(3)写出氧化步骤中加入H2O2发生反应的离子方程式2Fe2++H2O2+2H+═2Fe3++2H2O.
(4)酸浸过程中,1mol NiS失去6NA个电子,同时生成两种无色有毒气体.写出该反应的化学方程式NiS+H2SO4+2HNO3═NiSO4+SO2↑+2NO↑+2H2O.
(5)沉镍过程中,若c(Ni2+)=2.0mol•L-1,欲使100ml该滤液中的Ni2+沉淀物完全,[c(Ni2+)≤10-5mol•L-1],则需要加人Na2CO3固体的质量最少为1038.8g(保留小数点后1位有效数字)
(6)保持其他条件不变,在不同温度下对含镍废料进行酸浸.酸浸出率随时间变化如图.酸浸的最佳温度与时间分别为70℃、120min.

10.如图甲所示,纯电动公交车逐渐成为杭州街头常见的身影,磷酸铁锂电池是杭州市纯电动公交车所用的电池,现要从废旧磷酸铁锂电池中回收Fe、Al、Li等物质,采用图乙所示方法.已知:磷酸铁锂电池溶解在H2SO4中含有Fe3+、Al3+、Li+、SO42-、PO43-等离子及少量不溶物,滤液c中含有大量Li+离子,Li2CO3可溶于冷水,不溶于热水.下列说法不正确的是( )
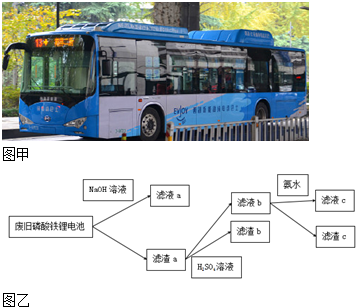

| A. | 向滤液a中加入适量H2SO4溶液,可以得到白色沉淀 | |
| B. | 滤液b中加入氨水的目的是使Fe3+沉淀,滤渣c为红褐色 | |
| C. | 要将Li从溶液中析出,可在滤液c中加入足量Na2CO3溶液,加热浓缩,冷却结晶 | |
| D. | 图中的氨水可以用适量NaOH溶液代替 |
17.与OH-具有相同质子数和电子数的微粒是( )
| A. | F2 | B. | Cl- | C. | NH3 | D. | NH2- |
15.现有四种元素的基态原子的电子排布式如下:①[Ne]3s23p4;②1s22s22p63s23p3;③1s22s22p5.则下列有关比较中不正确的是( )
| A. | 最高正化合价:③>②>① | B. | 原子半径:②>①>③ | ||
| C. | 电负性:③>①>② | D. | 第一电离能:③>②>① |
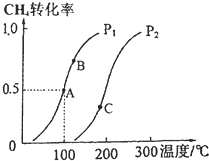 利用天然气可制得以H2、CO等为主要组成的工业原料合成气,反应为:CH4(g)+H2O(g)?CO(g)+3H2(g).
利用天然气可制得以H2、CO等为主要组成的工业原料合成气,反应为:CH4(g)+H2O(g)?CO(g)+3H2(g). .其基态原子有7种能量不同的电子;
.其基态原子有7种能量不同的电子;
 在生产生活中,卤族元素(F、Cl、Br、I)的单质及化合物用途广泛.
在生产生活中,卤族元素(F、Cl、Br、I)的单质及化合物用途广泛. ;从HF、HCl混合气体中分离出HF的方法是冷凝.
;从HF、HCl混合气体中分离出HF的方法是冷凝.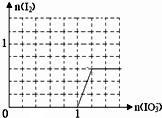 .
.