题目内容
15.现有四种元素的基态原子的电子排布式如下:①[Ne]3s23p4;②1s22s22p63s23p3;③1s22s22p5.则下列有关比较中不正确的是( )| A. | 最高正化合价:③>②>① | B. | 原子半径:②>①>③ | ||
| C. | 电负性:③>①>② | D. | 第一电离能:③>②>① |
分析 由核外电子排布式可知,①[Ne]3s23p4为S元素,②1s22s22p63s23p3为P元素,③1s22s22p5为F元素.
A.最高正化合价等于最外层电子数,注意F、O元素一般没有正化合价;
B.同周期自左而右原子半径减小,同主族自上而下原子半径增大;
C.同周期自左而右电负性增大,同主族自上而下电负性减小;
D.同周期随原子序数增大,元素的第一电离能呈增大趋势,但P元素原子3p能级为半满稳定状态,第一电离能高于同周期相邻元素,同主族自上而下第一电离能减弱.
解答 解:由核外电子排布式可知,①[Ne]3s23p4为S元素,②1s22s22p63s23p3为P元素,③1s22s22p5为F元素.
A.S元素最高正化合价为+6,P元素最高正化合价为+5,F没有正化合价,故最高正化合价:①>②,故A错误;
B.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径P>S>F,即②>①>③,故B正确;
C.同周期自左而右电负性增大,同主族自上而下电负性减小,故电负性③>①>②,故C正确;
D.同周期随原子序数增大,元素的第一电离能呈增大趋势,但P元素原子3p能级为半满稳定状态,第一电离能高于同周期相邻元素,同主族自上而下第一电离能减弱,故第一电离能F>P>S,即③>②>①,故D正确.
故选:A.
点评 本题考查核外电子排布规律、元素周期律等,难度不大,注意能级处于半满、全满时元素的第一电离能高于同周期相邻元素.

练习册系列答案
相关题目
5.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 澄清透明的溶液中:Na+、K+、MnO4-、NO3- | |
| B. | pH=13的溶液中:Na+、K+、SO42-、HCO3- | |
| C. | 0.1 mol•L-1 NaClO溶液中:K+、Na+、NO3-、I- | |
| D. | 0.1 mol•L-1 FeCl3溶液中:Na+、NH4+、SCN-、SO42- |
3. 某模拟“人工树叶”电化学实验装置如下图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O),下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如下图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O),下列说法正确的是( )
 某模拟“人工树叶”电化学实验装置如下图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O),下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如下图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O),下列说法正确的是( )| A. | 该装置将化学能转化为光能和电能 | |
| B. | a电极的反应为:3CO2+18H+-18e-═C3H8O+5H2O | |
| C. | 每生成1 mol O2,有44 g CO2被还原 | |
| D. | 该装置工作时H+从b极区向a极区迁移 |
10.下列有关化学用语的表示错误的是( )
| A. | 甲烷的比例模型: | B. | 氯离子的结构示意图: | ||
| C. | 氮气分子的结构式:N≡N | D. | 过氧化钠的电子式: |
20.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,0.1molC3H8所含有的共价键数目为1.1 NA | |
| B. | 1mol苯分子中,含有碳碳双键的数目为3 NA | |
| C. | 常温常压下,15g甲基(-CH3)所含的电子数为10NA | |
| D. | 现有乙烯、丙烯的混合气体共14 g,其原子数为3NA |
7.双羟香豆素医学上用作抗凝剂,其结构如图.下列有关双羟香豆素的说法正确的是( )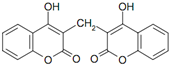

| A. | 分子式为C19H10O6 | |
| B. | 遇FeCl3溶液能发生显色反应 | |
| C. | 1 mol双羟香豆素最多能与含 4 mol氢氧化钠的水溶液完全反应 | |
| D. | 1 mol双羟香豆素最多能与 10 mol氢气发生加成反应 |
4.下列说法正确的是( )
| A. | 3Cl2(g)+8NH3(g)═6NH4Cl(s)+N2(g)在常温下能自发进行,则该反应的△H<0 | |
| B. | 电解精炼铜时,电解液中CuSO4的物质的量浓度不变 | |
| C. | 室温下,体积、pH均相同的HA和HB两种酸分别与足量的锌反应,HA放出氢气多,说明酸性:HB>HA | |
| D. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大 |
5.下列有关溶液的特征说法不正确的是( )
| A. | 食盐水任意部分味道相同 | B. | 氯化铁溶液为浅绿色 | ||
| C. | 水不是混合物所以不是溶液 | D. | 在溶液中进行反应时速度较快 |
 .
.