题目内容
现有下列物质:①碳酸氢钠 ②氧化钠 ③SO2 ④铁 ⑤氢氧化钙 ⑥硫酸 ⑦乙醇 请将上述物质按下列要求分类,并将其序号填入空白处:
(1)按组成分类,属于单质的是 ,属于酸性氧化物的是 ,属于碱性氧化物的是 ;属于酸的是 ,属于碱的是 ,属于盐的是 .
(2)按是否是电解质分类,属于电解质的是 ,属于非电解质的是 .
(1)按组成分类,属于单质的是
(2)按是否是电解质分类,属于电解质的是
考点:酸、碱、盐、氧化物的概念及其相互联系,电解质与非电解质
专题:物质的分类专题
分析:单质是有同种元素组成的纯净物;
酸性氧化物是和碱反应生成盐和水的氧化物;
碱性氧化物是和酸反应生成盐和水的氧化物;
酸是水溶液中电离出的阳离子全部是氢离子的化合物;
碱是水溶液中电离出的阴离子全部是氢氧根离子的化合物;
盐是金属阳离子和酸根阴离子构成的化合物,铵盐例外;
电解质指在水溶液中或熔融状态下能够导电的化合物;在上述两种情况下都不能导电的化合物称为非电解质;单质,混合物既不是电解质也不是非电解质; 根据以上概念进行判断.
酸性氧化物是和碱反应生成盐和水的氧化物;
碱性氧化物是和酸反应生成盐和水的氧化物;
酸是水溶液中电离出的阳离子全部是氢离子的化合物;
碱是水溶液中电离出的阴离子全部是氢氧根离子的化合物;
盐是金属阳离子和酸根阴离子构成的化合物,铵盐例外;
电解质指在水溶液中或熔融状态下能够导电的化合物;在上述两种情况下都不能导电的化合物称为非电解质;单质,混合物既不是电解质也不是非电解质; 根据以上概念进行判断.
解答:
解:(1)①碳酸氢钠,由金属离子和酸根离子组成,属于盐,是电解质;
②氧化钠,由氧元素和钠元素组成,属于氧化物,和酸反应生成盐和水属于碱性氧化物,是电解质;
③SO2,由硫元素和氧元素组成,属于氧化物,和碱反应生成盐和水,属于酸性氧化物,是非电解质;
④铁,由一种元素组成的纯净物,属于单质;
⑤氢氧化钙,能够电离出氢氧根离子,属于碱,是电解质;
⑥硫酸,由不同元素组成的纯净物,水溶液中电离出的阳离子全部是氢离子,属于酸,是电解质;
⑦乙醇,由不同元素组成的纯净物,属于化合物,是非电解质;
所以属于单质的有:④,属于酸性氧化物的是③,属于碱性氧化物的是②,属于酸的是⑥,属于碱的是⑤,属于盐的是①,
故答案为:④;③;②;⑥;⑤;①;
(2)电解质是指在水溶液中或熔融状态下能够导电的化合物;在上述两种情况下都不能导电的化合物称为非电解质;单质,混合物既不是电解质也不是非电解质;
上述分析可以属于电解质的是①②⑤⑥;属于非电解质的是③⑦,
故答案为:①②⑤⑥;③⑦.
②氧化钠,由氧元素和钠元素组成,属于氧化物,和酸反应生成盐和水属于碱性氧化物,是电解质;
③SO2,由硫元素和氧元素组成,属于氧化物,和碱反应生成盐和水,属于酸性氧化物,是非电解质;
④铁,由一种元素组成的纯净物,属于单质;
⑤氢氧化钙,能够电离出氢氧根离子,属于碱,是电解质;
⑥硫酸,由不同元素组成的纯净物,水溶液中电离出的阳离子全部是氢离子,属于酸,是电解质;
⑦乙醇,由不同元素组成的纯净物,属于化合物,是非电解质;
所以属于单质的有:④,属于酸性氧化物的是③,属于碱性氧化物的是②,属于酸的是⑥,属于碱的是⑤,属于盐的是①,
故答案为:④;③;②;⑥;⑤;①;
(2)电解质是指在水溶液中或熔融状态下能够导电的化合物;在上述两种情况下都不能导电的化合物称为非电解质;单质,混合物既不是电解质也不是非电解质;
上述分析可以属于电解质的是①②⑤⑥;属于非电解质的是③⑦,
故答案为:①②⑤⑥;③⑦.
点评:本题考查了电解质的概念、物质的分类,题目难度不大,注意掌握好电解质和非电解质的概念、物质的分类依据.

练习册系列答案
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
将agNa加入到一定量的稀H2SO4中,使两者恰好完全反应,得到b升气体(标况下),所得溶液中共有C个溶质的离子,阿伏伽德罗常数为NA,则下列关系式正确的是( )
A、NA=
| ||||
B、NA=
| ||||
C、
| ||||
| D、以上均不正确 |
下列有关除杂的实验操作合理的是( )
| A、除去二氧化碳中混有的少量一氧化碳:通入适量氧气后点燃 |
| B、除去氧气中少量氮气:使气体通过炽热的铜粉 |
| C、除去石英中少量碳酸钙:用稀盐酸溶解后过滤 |
| D、除去氯化钠固体中少量的纯碱:加入足量氯化钙,过滤、蒸发、结晶 |
它们的氯化物的化学式,最可能正确的是( )
| A、QCl2 |
| B、RCl3 |
| C、SCl2 |
| D、TCl |
 X、Y、Z三种常见元素的单质,甲、乙是两种常见的化合物,相互间有如图转化关系.回答下列问题:
X、Y、Z三种常见元素的单质,甲、乙是两种常见的化合物,相互间有如图转化关系.回答下列问题: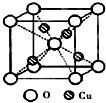 决定物质性质的重要因素是物质结构.请回答下列问题:
决定物质性质的重要因素是物质结构.请回答下列问题: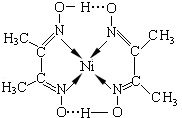
 某课外学习小组的同学欲验证碳、硅、硫的非金属性强弱,并给出下列的试剂供选择实验试剂:①浓盐酸、②稀H2SO4、③饱和Na2SO3溶液、④大理石、⑤Na2CO3粉末、⑥Na2SiO3溶液.实验装置如图所示:
某课外学习小组的同学欲验证碳、硅、硫的非金属性强弱,并给出下列的试剂供选择实验试剂:①浓盐酸、②稀H2SO4、③饱和Na2SO3溶液、④大理石、⑤Na2CO3粉末、⑥Na2SiO3溶液.实验装置如图所示: