题目内容
0.1mol化合物甲在足量的氧气中完全燃烧后生成4.48LCO2(标况下测量),推测甲是( )
| A、CH4 |
| B、C2H4 |
| C、C3H6 |
| D、C6H6 |
考点:有关有机物分子式确定的计算
专题:烃及其衍生物的燃烧规律
分析:先根据标准状况下的气体摩尔体积计算出4.48L二氧化碳的物质的量,然后根据碳原子守恒计算出1mol该化合物中含有的碳原子的物质的量,从而确定该有机物分子中含有的碳原子数目,最后根据选项中碳原子数目进行判断.
解答:
解:标准状况下4.48LCO2的物质的量为:n(CO2)=
=0.2mol,
即:0.1mol甲完全燃烧生成了0.2mol二氧化碳,根据碳原子守恒,则0.1mol甲中含有0.2molC,
1mol化合物甲中含有碳原子的物质的量为:n(C)=
mol=2mol,
所以化合物甲中含有2个C原子,选项中只有B选项中的分子含有两个C,
故选B.
| 4.48L |
| 22.4L/mol |
即:0.1mol甲完全燃烧生成了0.2mol二氧化碳,根据碳原子守恒,则0.1mol甲中含有0.2molC,
1mol化合物甲中含有碳原子的物质的量为:n(C)=
| 0.2 |
| 0.1 |
所以化合物甲中含有2个C原子,选项中只有B选项中的分子含有两个C,
故选B.
点评:本题考查了确定有机物分子式的计算方法,题目难度不大,注意掌握确定有机物分子式、结构简式的方法,明确质量守恒、烃的燃烧通式确定有机物分子组成的方法.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
电子表所用电源常为微型银锌原电池,其电极为A2O和Zn,电解质溶液为KOH溶液,其电极反应分别为:Zn-2e-+2OH-=Zn(OH)2,Ag2O+H2O+2e-=Ag+2OH-,下列叙述正确的是( )
| A、Zn为正极,Ag2O为负极 |
| B、放电时,电池负极附近溶液的pH变大 |
| C、放电时,溶液中阴离子向Zn极方向移动 |
| D、放电时,电流由Zn极经外电路流向Ag2O极 |
下列叙述中,正确的是( )
| A、乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 |
| B、聚乙烯可发生加成反应 |
| C、所有的糖类、油脂和蛋白质都能发生水解反应 |
| D、符合分子式C4H10的物质有4种 |
下列不可以证明b、c金属性强弱的是 ( )
| A、最高价氧化物对应水化物的溶解性:b<c |
| B、单质与水反应的剧烈程度:b<c |
| C、相同条件下,氯化物水溶液的pH值:b<c |
| D、可以从b的氯化物水溶液中置换出b. |
下列有机物的命名正确的是( )
A、 2-甲基-3-丁烯 |
B、 乙苯 |
C、 2-乙基丙烷 |
D、 1-甲基乙醇 |
根据下表信息,判断以下叙述正确的是( )
表:部分短周期元素的原子半径及主要化合价
表:部分短周期元素的原子半径及主要化合价
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A、氢化物的沸点为H2T<H2R |
| B、M、Q元素的金属性 L<M |
| C、工业上通过电解L与T形成的化合物生产单质L |
| D、离子半径:R2->T2->L2+>M3+ |
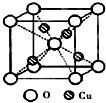 决定物质性质的重要因素是物质结构.请回答下列问题:
决定物质性质的重要因素是物质结构.请回答下列问题: