题目内容
 2012年3月,新《环境空气质量标准》的颁布表明国家对环境问题的进一步重视.
2012年3月,新《环境空气质量标准》的颁布表明国家对环境问题的进一步重视.(1)汽车上加装尾气催化净化装置(见图),可以使NO、CO相互反应转化为CO2和
(2)煤燃烧产生的SO2所形成的酸雨中,SO2最终转化成的酸是
考点:常见的生活环境的污染及治理
专题:热点问题
分析:(1)汽车上加装尾气催化净化装置,应使汽车尾气转化为对大气没有污染的气体,再结合元素守恒判断;
(2)酸雨中二氧化硫与水反应生成亚硫酸,亚硫酸不稳定,被氧气氧化为硫酸.
(2)酸雨中二氧化硫与水反应生成亚硫酸,亚硫酸不稳定,被氧气氧化为硫酸.
解答:
解:(1)汽车上加装尾气催化净化装置,应使汽车尾气转化为对大气没有污染的气体,结合N元素守恒可知,另外生成的气体应是N2,即NO、CO相互反应转化为CO2和N2,故答案为:N2;
(2)酸雨中二氧化硫与水反应生成亚硫酸,亚硫酸不稳定,被氧气氧化为硫酸,故答案为:H2SO4.
(2)酸雨中二氧化硫与水反应生成亚硫酸,亚硫酸不稳定,被氧气氧化为硫酸,故答案为:H2SO4.
点评:本题主要考查环境污染与防治、二氧化硫性质、胶体净水等,难度不大,注意知识的积累与运用.

练习册系列答案
相关题目
下列有关晶体的叙述中,正确的是( )
| A、在CaF2晶体中,Ca2+、F-的配位数均为8 |
| B、C60晶体中,微粒之间通过共价键结合形成晶体,键角为120° |
| C、在CsCl晶体中,每个Cs+周围紧邻6个Cl- |
| D、金刚石的网状结构中,由共价键形成的最小碳环上有6个碳原子 |
下列不可以证明b、c金属性强弱的是 ( )
| A、最高价氧化物对应水化物的溶解性:b<c |
| B、单质与水反应的剧烈程度:b<c |
| C、相同条件下,氯化物水溶液的pH值:b<c |
| D、可以从b的氯化物水溶液中置换出b. |
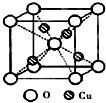 决定物质性质的重要因素是物质结构.请回答下列问题:
决定物质性质的重要因素是物质结构.请回答下列问题: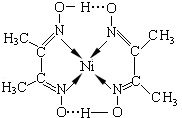
 Ⅰ.在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则:
Ⅰ.在t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则: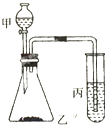 某课外学习小组的同学欲验证碳、硅、硫的非金属性强弱,并给出下列的试剂供选择实验试剂:①浓盐酸、②稀H2SO4、③饱和Na2SO3溶液、④大理石、⑤Na2CO3粉末、⑥Na2SiO3溶液.实验装置如图所示:
某课外学习小组的同学欲验证碳、硅、硫的非金属性强弱,并给出下列的试剂供选择实验试剂:①浓盐酸、②稀H2SO4、③饱和Na2SO3溶液、④大理石、⑤Na2CO3粉末、⑥Na2SiO3溶液.实验装置如图所示: