题目内容
①元素的金属性越强,其对应最高氧化物水化物的碱性越 ;
②元素的 性越强,其对应气态氢化物的稳定性越 ;(用“>”或“<”回答下列问题)
③酸性:H2SiO3 H3PO4 气态氢化物稳定性:H2S HCl.
②元素的
③酸性:H2SiO3
考点:金属在元素周期表中的位置及其性质递变的规律,非金属在元素周期表中的位置及其性质递变的规律
专题:元素周期律与元素周期表专题
分析:①根据金属性与碱性强弱的关系分析;
②根据非金属性越强,氢化物越稳定判断;
③非金属性越强,对应最高价氧化物的水化物酸性越强,氢化物越稳定.
②根据非金属性越强,氢化物越稳定判断;
③非金属性越强,对应最高价氧化物的水化物酸性越强,氢化物越稳定.
解答:
解:①元素的金属性越强,其对应最高氧化物水化物的碱性越强;故答案为:强;
②元素的非金属性越强,形成的共价键越稳定,其对应气态氢化物的稳定性越稳定;故答案为:非金属性;稳定;
③元素的非金属性越强,其对应最高氧化物水化物的酸性越强,其对应气态氢化物的稳定性越稳定,已知非金属性:Si>P,则酸性:H2SiO3>H3PO4;
非金属性:S<Cl,则气态氢化物稳定性:H2S<HCl;
故答案为:>;<.
②元素的非金属性越强,形成的共价键越稳定,其对应气态氢化物的稳定性越稳定;故答案为:非金属性;稳定;
③元素的非金属性越强,其对应最高氧化物水化物的酸性越强,其对应气态氢化物的稳定性越稳定,已知非金属性:Si>P,则酸性:H2SiO3>H3PO4;
非金属性:S<Cl,则气态氢化物稳定性:H2S<HCl;
故答案为:>;<.
点评:本题考查了元素性质的递变规律,把握非金属性和金属性的判断方法是解题的关键,题目难度不大.

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
下列有关除杂的实验操作合理的是( )
| A、除去二氧化碳中混有的少量一氧化碳:通入适量氧气后点燃 |
| B、除去氧气中少量氮气:使气体通过炽热的铜粉 |
| C、除去石英中少量碳酸钙:用稀盐酸溶解后过滤 |
| D、除去氯化钠固体中少量的纯碱:加入足量氯化钙,过滤、蒸发、结晶 |
下列有机物的命名正确的是( )
A、 2-甲基-3-丁烯 |
B、 乙苯 |
C、 2-乙基丙烷 |
D、 1-甲基乙醇 |
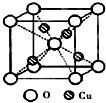 决定物质性质的重要因素是物质结构.请回答下列问题:
决定物质性质的重要因素是物质结构.请回答下列问题: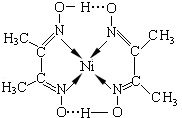
 某课外学习小组的同学欲验证碳、硅、硫的非金属性强弱,并给出下列的试剂供选择实验试剂:①浓盐酸、②稀H2SO4、③饱和Na2SO3溶液、④大理石、⑤Na2CO3粉末、⑥Na2SiO3溶液.实验装置如图所示:
某课外学习小组的同学欲验证碳、硅、硫的非金属性强弱,并给出下列的试剂供选择实验试剂:①浓盐酸、②稀H2SO4、③饱和Na2SO3溶液、④大理石、⑤Na2CO3粉末、⑥Na2SiO3溶液.实验装置如图所示: