题目内容
通常用燃烧的方法测定有机物的分子式,可在燃烧室内将有机物样品与纯氧在电炉加热下充分燃烧,根据产品的质量确定有机物的组成.如图所示的是用燃烧法确定有机物分子式的常用装置.

现准确称取0.44g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重0.88g,B管增重0.36g.请回答:
(1)按上述所给的测量信息,装置的连接顺序应是:D ;
(2)C管中浓硫酸的作用是 ;
(3)要确定该有机物的分子式,还必须知道的数据是 .
①C装置增加的质量 ②样品的摩尔质量 ③CuO固体减少的质量
(4)相同条件下,若该有机物蒸气对氢气的相对分子质量为22,且它的核磁共振氢谱上有两个峰,其强度比为3:1,试通过计算确定该有机物的结构简式.(要求写推理过程)

现准确称取0.44g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重0.88g,B管增重0.36g.请回答:
(1)按上述所给的测量信息,装置的连接顺序应是:D
(2)C管中浓硫酸的作用是
(3)要确定该有机物的分子式,还必须知道的数据是
①C装置增加的质量 ②样品的摩尔质量 ③CuO固体减少的质量
(4)相同条件下,若该有机物蒸气对氢气的相对分子质量为22,且它的核磁共振氢谱上有两个峰,其强度比为3:1,试通过计算确定该有机物的结构简式.(要求写推理过程)
考点:测定有机物分子的元素组成,有关有机物分子式确定的计算
专题:实验设计题
分析:(1)实验原理是测定一定质量的有机物完全燃烧时生成CO2和H2O的质量,来确定是否含氧及C、H、O的个数比,求出最简式;因此生成O2后必须除杂(主要是除H2O)明确各装置的作用是解题的前提,A用来吸收二氧化碳,测定生成二氧化碳的质量,B用来吸收水,测定生成水的质量,C用于干燥通入F中的氧气、D用来制取反应所需的氧气、F是在电炉加热时用纯氧气氧化管内样品;根据一氧化碳能与氧化铜反应,可被氧化成二氧化碳的性质可知CuO的作用是把有机物不完全燃烧产生的CO转化为CO2,据此对各装置进行排序;
(2)浓硫酸可以吸收氧气的中的水分,避免影响测定结果;
(3)题中该实验方法只能获得有机物的实验式,要确定有机物的分子式,还要知道有机物的相对分子质量;
(4)根据题干数据计算出该有机物的实验式,再根据核磁共振氢谱表示的意义确定该有机物的结构简式.
(2)浓硫酸可以吸收氧气的中的水分,避免影响测定结果;
(3)题中该实验方法只能获得有机物的实验式,要确定有机物的分子式,还要知道有机物的相对分子质量;
(4)根据题干数据计算出该有机物的实验式,再根据核磁共振氢谱表示的意义确定该有机物的结构简式.
解答:
解:(1)D中生成的氧气中含有水蒸气,应先通过C中的浓硫酸干燥,在E中电炉加热时用纯氧氧化管内样品,生成二氧化碳和水,如有一氧化碳生成,则E中CuO可与CO进一步反应生成二氧化碳,然后分别通入B(吸收水)、A(吸收二氧化碳)中,根据产物的质量推断有机物的组成,则产生的氧气按从左到右流向,所选置的连接顺序应是:D→C→F→B→A,
故答案为:CFBA;
(2)D中生成的氧气中含有水蒸气,应先通过C中的浓硫酸干燥,以免影响实验结果,故答案为:除去氧气中的水蒸气;
(3)由上题干测量数据能够计算出该有机物的实验式,要确定有机物的分子式,还要知道有机物的相对分子质量,所以②正确,
故答案为:②;
(4)A管质量增加0.88g为二氧化碳的质量,n(CO2)=0.88g÷44g.mol-1=0.02mol,n(C)=n(CO2)=0.02mol,
B管质量增加0.36g是水的质量,n(H2O)=0.36g÷18g.mol-1=0.02mol,n(H)=2n(H2O)=0.04mol,
从而可推出含氧元素的质量为:0.44g-12g/mol×0.02mol-1g/mol×0.04mol=0.16g,n(O)=
=0.01mol,
设最简式为CXHYOZ,则n(C):n(H):n(O)=0.02mol:0.04mol:0.01mol=2:4:1,
故该物质最简式为C2H4O,
该有机物蒸气对氢气的相对分子质量为22,则该有机物的摩尔质量为:2g/mol×22=44g/mol,其相对分子量为44,
设该物质分子式为(C2H4O)n,44n=44,解得:n=1,
故该物质分子式为C2H4O,
又根据题意:它的核磁共振氢谱上有两个峰,其强度比为3:1,可推出该有机物的结构简式为:CH3CHO,
答:该有机物的结构简式为CH3CHO.
故答案为:CFBA;
(2)D中生成的氧气中含有水蒸气,应先通过C中的浓硫酸干燥,以免影响实验结果,故答案为:除去氧气中的水蒸气;
(3)由上题干测量数据能够计算出该有机物的实验式,要确定有机物的分子式,还要知道有机物的相对分子质量,所以②正确,
故答案为:②;
(4)A管质量增加0.88g为二氧化碳的质量,n(CO2)=0.88g÷44g.mol-1=0.02mol,n(C)=n(CO2)=0.02mol,
B管质量增加0.36g是水的质量,n(H2O)=0.36g÷18g.mol-1=0.02mol,n(H)=2n(H2O)=0.04mol,
从而可推出含氧元素的质量为:0.44g-12g/mol×0.02mol-1g/mol×0.04mol=0.16g,n(O)=
| 0.16g |
| 16g/mol |
设最简式为CXHYOZ,则n(C):n(H):n(O)=0.02mol:0.04mol:0.01mol=2:4:1,
故该物质最简式为C2H4O,
该有机物蒸气对氢气的相对分子质量为22,则该有机物的摩尔质量为:2g/mol×22=44g/mol,其相对分子量为44,
设该物质分子式为(C2H4O)n,44n=44,解得:n=1,
故该物质分子式为C2H4O,
又根据题意:它的核磁共振氢谱上有两个峰,其强度比为3:1,可推出该有机物的结构简式为:CH3CHO,
答:该有机物的结构简式为CH3CHO.
点评:本题考查有机物的分子式的实验测定,题目难度中等,关键在于清楚实验的原理,掌握燃烧法利用元素守恒确定实验式的方法,试题侧重考查学生运用所学化学知识综合分析和解决实际问题的能力,强调了学生整合知识的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列热化学方程式或离子方程式中,正确的是( )
| A、甲烷的标准燃烧热为-890.3kJ?mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ?mol-1 | |||
B、500℃、30MPa下,将0.5mol N2和1.5mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)
| |||
| C、氯化镁溶液与氨水反应:Mg2++2OH-═Mg(OH)2↓ | |||
| D、氧化铝溶于NaOH溶液:Al2O3+2OH-+3H2O═2Al(OH)3 |
它们的氯化物的化学式,最可能正确的是( )
| A、QCl2 |
| B、RCl3 |
| C、SCl2 |
| D、TCl |
下列叙述中,正确的是( )
| A、乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别 |
| B、聚乙烯可发生加成反应 |
| C、所有的糖类、油脂和蛋白质都能发生水解反应 |
| D、符合分子式C4H10的物质有4种 |
 X、Y、Z三种常见元素的单质,甲、乙是两种常见的化合物,相互间有如图转化关系.回答下列问题:
X、Y、Z三种常见元素的单质,甲、乙是两种常见的化合物,相互间有如图转化关系.回答下列问题: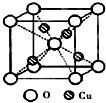 决定物质性质的重要因素是物质结构.请回答下列问题:
决定物质性质的重要因素是物质结构.请回答下列问题: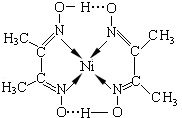
 某课外学习小组的同学欲验证碳、硅、硫的非金属性强弱,并给出下列的试剂供选择实验试剂:①浓盐酸、②稀H2SO4、③饱和Na2SO3溶液、④大理石、⑤Na2CO3粉末、⑥Na2SiO3溶液.实验装置如图所示:
某课外学习小组的同学欲验证碳、硅、硫的非金属性强弱,并给出下列的试剂供选择实验试剂:①浓盐酸、②稀H2SO4、③饱和Na2SO3溶液、④大理石、⑤Na2CO3粉末、⑥Na2SiO3溶液.实验装置如图所示: