题目内容
2.天然水因含有Ca2+、Mg2+、HCO3-等离子,煮沸后会形成水垢.现有一种干燥水垢6.32g,加热除去全部结晶水,得到固体M 5.78g;高温灼烧M至恒重,残余固体为CaO和MgO;放出的气体通入足量澄清石灰水中,产生沉淀6.00g;若产生的气体完全被碱石灰吸收,碱石灰增重2.82g.下列推断合理的是( )| A. | M 中一定不含Mg(OH)2 | B. | M中一定含有MgCO3 | ||
| C. | 5.78 g M中含CaCO30.05mol | D. | 水垢中碳酸盐质量分数为0.823 |
分析 放出的气体通入足量澄清石灰水中,产生沉淀6.00g,可知n(CO2)=n(CaCO3)=$\frac{6.00g}{100g/mol}$=0.06mol,
假设二氧化碳全部来自碳酸钙,则m(CaCO3)=0.06mol×100g/mol=6g,6.00>5.78,A中一定有MgCO3,
5.78g剩余固体A灼烧生成二氧化碳的质量为0.06mol×44g/mol=2.64g,碱石灰增重2.82g,故生成水的质量为2.82g-2.64g=0.18g,固体A中含有氢氧化镁,由H元素守恒则:n[Mg(OH)2]=n(H2O)=$\frac{0.18g}{18g/mol}$=0.01mol,故m[Mg(OH)2]=0.01mol×58g/mol=0.58g,n(CaCO3)+n(MgCO3)=0.06mol,n(CaCO3)×100g/mol+n(MgCO3)×84g/mol+0.58g=5.78g,解得:n(MgCO3)=0.05mol,n(CaCO3)=0.01mol,以此解答该题.
解答 解:放出的气体通入足量澄清石灰水中,产生沉淀6.00g,可知n(CO2)=n(CaCO3)=$\frac{6.00g}{100g/mol}$=0.06mol,
假设二氧化碳全部来自碳酸钙,则m(CaCO3)=0.06mol×100g/mol=6g,6.00>5.78,A中一定有MgCO3,
5.78g剩余固体A灼烧生成二氧化碳的质量为0.06mol×44g/mol=2.64g,碱石灰增重2.82g,故生成水的质量为2.82g-2.64g=0.18g,固体A中含有氢氧化镁,由H元素守恒则:n[Mg(OH)2]=n(H2O)=$\frac{0.18g}{18g/mol}$=0.01mol,故m[Mg(OH)2]=0.01mol×58g/mol=0.58g,n(CaCO3)+n(MgCO3)=0.06mol,n(CaCO3)×100g/mol+n(MgCO3)×84g/mol+0.58g=5.78g,解得:n(MgCO3)=0.05mol,n(CaCO3)=0.01mol,
A.由以上分析可知一定含有Mg(OH)2,故A错误;
B.由以上分析可知一定含有MgCO3,故B正确;
C.由以上分析可知M中含CaCO30.01mol,故C错误;
D.水垢中碳酸盐质量分数为$\frac{0.05mol×84g/mol+0.01mol×100g/mol}{6.32g}$=0.823,故D正确.
故选BD.
点评 本题考查混合物的有关计算,为高考常见题型,侧重于学生的分析、计算能力的考查,难度中等,注意利用假设法进行碳酸镁的确定,利用计算确定含有氢氧化镁是关键.

| A. | E(反应物)>E(生成物) | B. | E(反应物)<E(生成物) | C. | 反应放热 | D. | 反应吸热 |
| A. | 放热的自发过程都是熵值减小的过程 | |
| B. | 吸热的自发过程常常是熵值增加的过程 | |
| C. | 水自发地从高处流向低处,是趋向能量最低状态的倾向 | |
| D. | 只根据焓变来判断化学反应的方向是可以的 |
| A. | 两种溶液中由水电离出来的c(H+)不相同 | |
| B. | 将两溶液等体积混合,则c(H+)>c(CH3COO-)═c(Cl-)>c(OH-) | |
| C. | 分别用蒸馏水稀释m倍和n倍,若两溶液pH仍相同,则m<n | |
| D. | 中和相同体积的两种酸溶液所需NaOH的物质的量相同 |
| A. | CH3COOH溶液中CH3COOH的电离:CH3COOH=H ++CH3COO- | |
| B. | 用CuCl2溶液做导电实验,灯泡发光:CuCl2$\frac{\underline{\;电解\;}}{\;}$Cu2++2Cl- | |
| C. | NaHCO3溶液中HCO3-的水解:HCO3-+H2 O?H3 O ++CO32- | |
| D. | 将FeCl3溶液滴入Na2CO3溶液中:2Fe3++3 CO32?+3 H2 O═2Fe(OH)3↓+3 CO2↑ |
①金属钠投入到氯化铁溶液
②过量氢氧化钠溶液和明矾溶液
③碳酸氢钡溶液和硫酸氢钠溶液
④过氧化钠投入氯化铁溶液.
| A. | ①④ | B. | ②③④ | C. | ②③ | D. | ①③④ |
| A. | 碳酸氢钠溶液中滴加稀盐酸 | B. | 硫酸铁溶液中滴加硫氰化钾溶液 | ||
| C. | 碘水中滴加淀粉碘化钾溶液 | D. | 氯化铁溶液中加入还原性铁粉 |
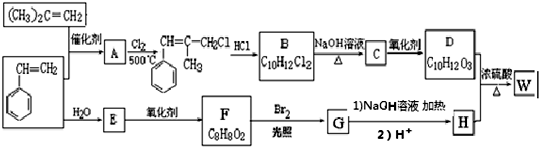
 .
.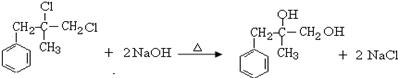 ;由D生成高分子化合物的方程式为
;由D生成高分子化合物的方程式为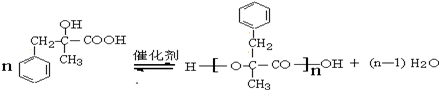 .
.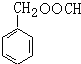 (写结构简式).
(写结构简式).