题目内容
7.常温下时,有pH=3的盐酸和醋酸溶液,下列说法正确的是( )| A. | 两种溶液中由水电离出来的c(H+)不相同 | |
| B. | 将两溶液等体积混合,则c(H+)>c(CH3COO-)═c(Cl-)>c(OH-) | |
| C. | 分别用蒸馏水稀释m倍和n倍,若两溶液pH仍相同,则m<n | |
| D. | 中和相同体积的两种酸溶液所需NaOH的物质的量相同 |
分析 醋酸是弱酸,存在电离平衡,pH=3的盐酸和醋酸溶液中氢离子浓度相同,醋酸浓度大于盐酸的浓度,加水稀释促进醋酸电离,氢离子浓度增大抑制醋酸电离,据此分析.
解答 解:A、pH=3的盐酸和醋酸溶液中氢离子浓度相同,对水的电离的抑制作用相同,由水电离出来的c(H+)相同,故A错误;
B、两溶液等体积混合,氢离子浓度不变,温度不变醋酸的电离平衡常数不变,c(CH3COO-)与c(CH3COOH)都变为原浓度的$\frac{1}{2}$,所以醋酸的电离平衡没有移动,则c(H+)=2c(CH3COO-)=2c(Cl-)>c(OH-),故B错误;
C、加水稀释促进醋酸电离,盐酸和醋酸用燕馏水稀释m倍和n倍,若两溶液pH仍相同,醋酸加水稀释倍数高,所以则m<n,故C正确;
D、pH=3的盐酸和醋酸溶液中氢离子浓度相同,醋酸浓度大于盐酸的浓度,中和相同体积的两种酸溶液所需NaOH的物质的量醋酸多于盐酸,故D错误;
故选C.
点评 本题考查了弱电解质的电离,明确弱电解质的电离特点即可解答,知道影响水电离的因素,知道影响弱酸电离平衡移动的因素,为易错点,题目难度中等.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目
11.有关晶胞的叙述正确的是( )
| A. | 晶胞是晶体结构中的基本结构单元 | |
| B. | 根据晶体的不同,晶胞可以是多种形状的几何体 | |
| C. | 晶胞一般都是平行六面体 | |
| D. | 晶胞都是正八面体 |
8.下列物质中,熵值(s)最大的是( )
| A. | 金刚石 | B. | Cl2(l) | C. | I2(g) | D. | Cu(s) |
2.天然水因含有Ca2+、Mg2+、HCO3-等离子,煮沸后会形成水垢.现有一种干燥水垢6.32g,加热除去全部结晶水,得到固体M 5.78g;高温灼烧M至恒重,残余固体为CaO和MgO;放出的气体通入足量澄清石灰水中,产生沉淀6.00g;若产生的气体完全被碱石灰吸收,碱石灰增重2.82g.下列推断合理的是( )
| A. | M 中一定不含Mg(OH)2 | B. | M中一定含有MgCO3 | ||
| C. | 5.78 g M中含CaCO30.05mol | D. | 水垢中碳酸盐质量分数为0.823 |
12.已知室温时,0.1mol?L-1 某一元酸 HA 在水中有 0.1%发生电离,下列叙述错误的是( )
| A. | 该溶液的 pH=4 | |
| B. | 升高温度,溶液的 pH 增大 | |
| C. | 此酸的电离平衡常数约为 1×10-7 | |
| D. | 由 HA 电离出的 c(H+)约为水电离出的 c(H+)的106倍 |
19.在已达到电离平衡的0.1mol/L的醋酸溶液中,欲使平衡向电离的方向移动,同时使溶液的pH降低,应采取的措施是( )
| A. | 加少量盐酸 | B. | 加热 | ||
| C. | 加少量醋酸钠晶体 | D. | 加少量NaOH晶体 |
17.下列各组物质互为同分异构体的是( )
| A. | 乙烷和乙烯 | B. | 乙醇与乙醛 | ||
| C. | 乙酸与甲酸甲酯(HCOOCH3) | D. | 淀粉和纤维素 |

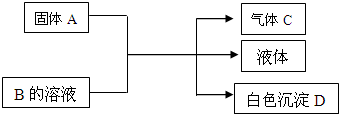 A、B、C、D均为中学化学常见的物质,它们间的反应关系如图所示.
A、B、C、D均为中学化学常见的物质,它们间的反应关系如图所示.