题目内容
11.下列各组物质相互混合反应,既有气体生成,最终又有沉淀生成的是( )①金属钠投入到氯化铁溶液
②过量氢氧化钠溶液和明矾溶液
③碳酸氢钡溶液和硫酸氢钠溶液
④过氧化钠投入氯化铁溶液.
| A. | ①④ | B. | ②③④ | C. | ②③ | D. | ①③④ |
分析 ①金属钠投入FeCl3溶液中,钠与水反应,产物氢氧化钠与FeCl3反应;
②明矾电离出Al3+,与过量的NaOH溶液反应生成可溶性的偏铝酸盐;
③反应生成白色沉淀硫酸钡和二氧化碳气体;
④Na2O2具有强氧化性,能氧化FeCl2.
解答 解:①钠浮在水面上,与水剧烈反应,并放出大量热,熔化成小球,黄色的溶液变成红色沉淀,发生2Na+H2O=2NaOH+H2↑、3NaOH+FeCl3=3NaCl+Fe(OH)3↓,故既有气体生成最终又有沉淀生成;
②过量的NaOH溶液和明矾溶液反应的方程式为:KAl(SO4)2•12H2O+4NaOH=KAlO2+14H2O+2Na2SO4,故无气体生成,最终又无沉淀生成;
③碳酸氢钡溶液和硫酸氢钠溶液反应生成硫酸钡沉淀和二氧化碳气体,故既有气体生成,最终又有沉淀生成;
④Na2O2与水反应:2Na2O2+2H2O=4NaOH+O2↑,NaOH与FeCl2发生反应:2NaOH+FeCl2=Fe(OH)2↓+2NaCl,Fe(OH)2被水中Na2O2与水反应生成的氧气和空气中的氧气氧化4Fe(OH)2 +O2 +2H2O=4Fe(OH)3现象为:有气体和红褐色沉淀生成,故既有气体生成最终又有沉淀生成;
故选D.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的综合应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.天然水因含有Ca2+、Mg2+、HCO3-等离子,煮沸后会形成水垢.现有一种干燥水垢6.32g,加热除去全部结晶水,得到固体M 5.78g;高温灼烧M至恒重,残余固体为CaO和MgO;放出的气体通入足量澄清石灰水中,产生沉淀6.00g;若产生的气体完全被碱石灰吸收,碱石灰增重2.82g.下列推断合理的是( )
| A. | M 中一定不含Mg(OH)2 | B. | M中一定含有MgCO3 | ||
| C. | 5.78 g M中含CaCO30.05mol | D. | 水垢中碳酸盐质量分数为0.823 |
19.在已达到电离平衡的0.1mol/L的醋酸溶液中,欲使平衡向电离的方向移动,同时使溶液的pH降低,应采取的措施是( )
| A. | 加少量盐酸 | B. | 加热 | ||
| C. | 加少量醋酸钠晶体 | D. | 加少量NaOH晶体 |
3.关于下列各图的叙述,正确的是( )
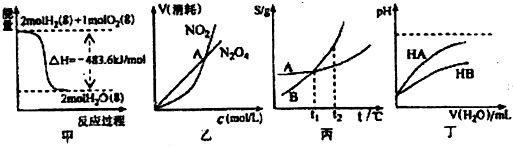

| A. | 甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6kJ•mol-l | |
| B. | 乙表示恒温恒容条件下发生的可逆反应2NO2?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| C. | 丙表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数B=A | |
| D. | 丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH大于NaB溶液 |
1.下列关于多电子原子核外电子的运动规律的叙述正确的是( )
| A. | 原子核外各电子层上的电子数均已达到2n2 | |
| B. | 所有电子在同一区域里运动 | |
| C. | 能量高的电子在离核近的区域运动 | |
| D. | 能量低的电子在离核近的区域绕核运动 |
 钒及其化合物非常丰富.钒可用于生产合金钢、航天用的钒钛合金及化工催化剂等.
钒及其化合物非常丰富.钒可用于生产合金钢、航天用的钒钛合金及化工催化剂等.
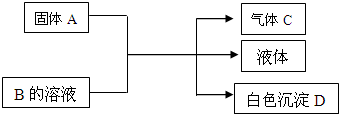 A、B、C、D均为中学化学常见的物质,它们间的反应关系如图所示.
A、B、C、D均为中学化学常见的物质,它们间的反应关系如图所示.