题目内容
10.下列说法中,正确的是( )| A. | 放热的自发过程都是熵值减小的过程 | |
| B. | 吸热的自发过程常常是熵值增加的过程 | |
| C. | 水自发地从高处流向低处,是趋向能量最低状态的倾向 | |
| D. | 只根据焓变来判断化学反应的方向是可以的 |
分析 反应能否自己进行与焓变与熵变都有关系,反应自发进行的判断依据是△H-T△S<0,自发进行的反应也需要一定条件才可以发生,据此判断.
解答 解:A.反应自发进行的判断依据是△H-T△S<0,自发进行的反应也需要一定条件才可以发生,放热的自发过程,△H<0,△S可能小于0也可能大于0,故A错误;
B.吸热的自发过程,△H>0,因T>0,须△H-T△S<0,取决于△S>0,所以吸热的自发过程一定为熵增加的过程,故B错误;
C.水总是自发地由高处往低处流,有趋向于最低能量状态的倾向,故C正确;
D.反应能否自己进行与焓变与熵变都有关系,反应能否自发进行需看△H-T△S是否小于0,故D错误;
故选:C.
点评 本题考查了反应自发进行的判断依据,明确反应焓变、熵变与反应自发进行的关系是解题关键,题目难度不大.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
20.我国药学家屠呦呦因发现植物黄花蒿叶中含有抗疟疾的物质-青蒿素而荣获2015年诺贝尔奖.科学家对青蒿素的结构进行进一步改良,合成药效更佳的双氢青蒿素、蒿甲醚.下列说法正确的是( )

| A. | 利用黄花蒿叶研究青蒿素结构的基本步骤为:元素分析确定实验式→测定相对分子质量确定分子式→波谱分析确定结构式 | |
| B. | ①、②的反应类型分别为还原反应、酯化反应 | |
| C. | 双氢青蒿素在水中的溶解性大于青蒿素 | |
| D. | 双氢青蒿素与蒿甲醚组成上相差-CH2-,二者互为同系物 |
2.天然水因含有Ca2+、Mg2+、HCO3-等离子,煮沸后会形成水垢.现有一种干燥水垢6.32g,加热除去全部结晶水,得到固体M 5.78g;高温灼烧M至恒重,残余固体为CaO和MgO;放出的气体通入足量澄清石灰水中,产生沉淀6.00g;若产生的气体完全被碱石灰吸收,碱石灰增重2.82g.下列推断合理的是( )
| A. | M 中一定不含Mg(OH)2 | B. | M中一定含有MgCO3 | ||
| C. | 5.78 g M中含CaCO30.05mol | D. | 水垢中碳酸盐质量分数为0.823 |
9.用0.1000mol•L-1标准NaOH溶液测定食醋中醋酸的含量,下列说法正确的是( )
| A. | 酸式滴定管、碱式滴定管及锥形瓶均需洗净后再润洗内壁2~3次 | |
| B. | 应该选择酚酞作指示剂 | |
| C. | 滴定过程中眼睛应始终注视滴定管内液面变化 | |
| D. | 读取标准液的刻度时,滴定前平视,滴定后仰视,测定结果偏低 |
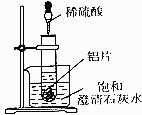 如图所示,把试管放人盛有25℃饱和澄清石灰水的烧杯中,开始往试管中加人若干铝片,再用滴管向试管中加人10mL1mol•L-1稀硫酸.
如图所示,把试管放人盛有25℃饱和澄清石灰水的烧杯中,开始往试管中加人若干铝片,再用滴管向试管中加人10mL1mol•L-1稀硫酸.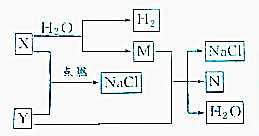 已知下列转化关系:
已知下列转化关系: