题目内容
6.NA表示阿伏加德罗常数,下列叙述正确的是( )| A. | 1 mol白磷中含共价键数均为4NA | |
| B. | 1 mol-CH3中含有的电子数为9 NA | |
| C. | 1 mol Na2O2 固体中含离子总数为4 NA | |
| D. | 标准状况下,2.24 L SO3所含分子数为0.1 NA |
分析 A、白磷分子中含6条共价键;
B、甲基中含9个电子;
C、过氧化钠由2个钠离子和1个过氧根构成;
D、标况下三氧化硫为固体.
解答 解:A、白磷分子中含6条共价键,故1mol白磷中含6mol即6NA条共价键,故A错误;
B、甲基中含9个电子,故1mol甲基中含9NA个电子,故B正确;
C、过氧化钠由2个钠离子和1个过氧根构成,故1mol过氧化钠固体中含3NA个离子,故C错误;
D、标况下三氧化硫为固体,故不能根据气体摩尔体积来计算其物质的量和分子个数,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
12.下列生活、生产中所采取措施的目的与反应速率无关的是( )
| A. | 在食品中加入着色剂 | B. | 轮船船身装锌块防腐 | ||
| C. | 在糕点包装内放置抗氧化剂 | D. | 燃煤发电时用煤粉代替煤块 |
14.下列变化中,属于加成反应的是( )
| A. | 乙炔通入酸性高锰酸钾溶液中,高锰酸钾溶液褪色 | |
| B. | 甲苯在一定条件下与浓硝酸反应生成三硝基甲苯 | |
| C. | 乙醇在一定条件下与氢溴酸反应生成溴乙烷 | |
| D. | 在一定条件下苯与氢气反应制取环己烷 |
1.Romanenko利用微生物电池将Cr2O72-催化还原的工作原理如图所示.下列说法正确的是( )

| A. | b极为负极 | |
| B. | a极反应式:CH3COOH+2H2O-8e-=2CO2+8H+ | |
| C. | 每处理1mol Cr2O72-生成CO2(标准状况下)3.36 L | |
| D. | 每生成lmol Cr(OH)3,右池n(H+)减少2 mol |
11. X、Y、Z、W均为短周期主族元素,其最高价氧化物对应水化物(常温下,浓度均为0.1mol•L-1)的pH和原子序数的关系如图所示.下列有关说法正确的是
X、Y、Z、W均为短周期主族元素,其最高价氧化物对应水化物(常温下,浓度均为0.1mol•L-1)的pH和原子序数的关系如图所示.下列有关说法正确的是
( )
 X、Y、Z、W均为短周期主族元素,其最高价氧化物对应水化物(常温下,浓度均为0.1mol•L-1)的pH和原子序数的关系如图所示.下列有关说法正确的是
X、Y、Z、W均为短周期主族元素,其最高价氧化物对应水化物(常温下,浓度均为0.1mol•L-1)的pH和原子序数的关系如图所示.下列有关说法正确的是( )
| A. | 简单离子半径:W>Z>Y>X | B. | 简单氢化物稳定性:X>Z>W | ||
| C. | 制造镁合金时可以用X2作保护气 | D. | 化合物Y2Z2中存在离子键和共价键 |
18.在给定的条件下,下列选项所示的物质间转化均能实现的是( )
| A. | H2SO4(浓)$\stackrel{Fe}{→}$SO2$\stackrel{BaCl_{2}(aq)}{→}$BaSO3(s) | |
| B. | NH3$→_{催化剂,△}^{O_{2}}$NO$\stackrel{H_{2}O}{→}$HNO3 | |
| C. | SiO2$→_{△}^{NaOH(AQ)}$Na2SiO3(aq)$\stackrel{足量CO_{2}}{→}$H2SiO3 | |
| D. | NaAlO2$\stackrel{盐酸}{→}$AlCl3(aq)$\stackrel{△}{→}$AlCl3(s) |
15.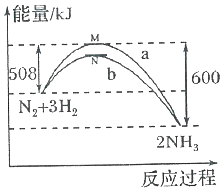 在一定温度时,N2与H2反应过程中能量变化的曲线如图,其中a表示不使用催化剂时的能量变化曲线,b表示使用催化剂时的能量变化曲线.下列叙述正确的是( )
在一定温度时,N2与H2反应过程中能量变化的曲线如图,其中a表示不使用催化剂时的能量变化曲线,b表示使用催化剂时的能量变化曲线.下列叙述正确的是( )
 在一定温度时,N2与H2反应过程中能量变化的曲线如图,其中a表示不使用催化剂时的能量变化曲线,b表示使用催化剂时的能量变化曲线.下列叙述正确的是( )
在一定温度时,N2与H2反应过程中能量变化的曲线如图,其中a表示不使用催化剂时的能量变化曲线,b表示使用催化剂时的能量变化曲线.下列叙述正确的是( )| A. | 状态M和N均表示2molN(g)+6mol H(g) | |
| B. | 该反应的热化学方程式为:N2+3H2?2NH3△H=-92kJ•mol-l | |
| C. | 使用催化剂,降低了反应进行所需的最低能量,增大了反应放出的能量 | |
| D. | 使用催化剂,并不能改变反应的△H |
16.常温下,在指定溶液中可以大量共存的离子是( )
| A. | 弱碱溶液中:Na+、K+、Cl-、HCO3- | |
| B. | 乙醇溶液中:K+、H+、SO42-、MnO4- | |
| C. | 中性溶液中:Fe3+、Mg2+、Cl-、SO42- | |
| D. | 加入铝粉后有气体产生的溶液中:Na+、Mg2+、NO3-、Cl- |
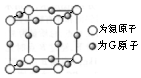 A、B、C、D、E、F、G是前四周期(除稀有气体)原子序数依次增大的七种元素,A的原子核外电子只有一种运动状态;B、C的价电子层中未成对电子数都是2;D、E、F同周期;E核外的s、p能级的电子总数相筹;F与E同周期且第一电离能比E小;G的+1价离子(G+)的各层电子全充满.回答问题:
A、B、C、D、E、F、G是前四周期(除稀有气体)原子序数依次增大的七种元素,A的原子核外电子只有一种运动状态;B、C的价电子层中未成对电子数都是2;D、E、F同周期;E核外的s、p能级的电子总数相筹;F与E同周期且第一电离能比E小;G的+1价离子(G+)的各层电子全充满.回答问题: