题目内容
11. X、Y、Z、W均为短周期主族元素,其最高价氧化物对应水化物(常温下,浓度均为0.1mol•L-1)的pH和原子序数的关系如图所示.下列有关说法正确的是
X、Y、Z、W均为短周期主族元素,其最高价氧化物对应水化物(常温下,浓度均为0.1mol•L-1)的pH和原子序数的关系如图所示.下列有关说法正确的是( )
| A. | 简单离子半径:W>Z>Y>X | B. | 简单氢化物稳定性:X>Z>W | ||
| C. | 制造镁合金时可以用X2作保护气 | D. | 化合物Y2Z2中存在离子键和共价键 |
分析 X、Y、Z、W均为短周期主族元素,由其最高价氧化物对应水化物的pH和原子序数的关系图可知,X、W对应的pH为1,高氯酸、硝酸均为一元强酸,可知W为Cl,X为N,Z对应的pH小于1,则Z对应的酸为硫酸,可知Z为S,Y对应的pH=13,对应碱为NaOH,则Y为Na,以此来解答.
解答 解:由上述分析可知,X为N,Y为Na,Z为S,W为Cl,
A.电子层越多,离子半径越大,具有相同电子排布的离子中原子序数大的离子半径小,则简单离子半径:Z>W>X>Y,故A错误;
B.非金属性越强,对应氢化物越稳定,则简单氢化物稳定性:X>W>Z,故B错误;
C.Mg与氮气反应,不能作保护气,故C错误;
D.化合物Na2S2中存在离子键和S-S共价键,故D正确;
故选D.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子序数、最高价氧化物对应水化物的pH来推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
相关题目
2.常温下,分别将四块形状相同,质量均为6g的铁块同时投入下列四种溶液中,产生氢气速率最快的是( )
| A. | 400mL 2mol/L HCl | B. | 300mL 2mol/L H2SO4 | ||
| C. | 100mL 3mol/L HNO3 | D. | 500mL 18.4mol/L H2SO4 |
19.NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1 L 0.1mol/L NaHSO3溶液中含有HSO3-离子数为0.1NA | |
| B. | 50 mL 18.4 mol•L-1浓硫酸与足量铜反应,生成SO2分子数为0.46 NA | |
| C. | 1 mol H2和1 mol I2充分反应,可得到HI分子数为2NA | |
| D. | 2.2 g CO2与足量镁粉反应,转移电子数为0.2NA |
6.NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 1 mol白磷中含共价键数均为4NA | |
| B. | 1 mol-CH3中含有的电子数为9 NA | |
| C. | 1 mol Na2O2 固体中含离子总数为4 NA | |
| D. | 标准状况下,2.24 L SO3所含分子数为0.1 NA |
16.下列有关物质性质与用途对应关系正确的是( )
| A. | 氧化镁熔点高,可用于制造耐高温材料 | |
| B. | 次氯酸有酸性,可用于自来水的杀菌消毒 | |
| C. | 油脂在碱性条件下水解,可用于制硬化油 | |
| D. | 晶体硅熔点高、硬度大,可用于制作半导体材料 |
20.下列图示与对应的叙述相符合的是( )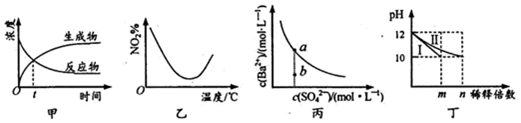

| A. | 图甲表示某可逆反应中物质浓度随时间的变化,反应在t时刻达到平衡状态 | |
| B. | 图乙表示NO2在恒容密闭容器中发生反应:2NO2(g)?N2O4(g),NO2体积分数与温度的变化曲线,则该反应的正反应△H<O | |
| C. | 图丙表示某温度时,BaSO4在水中的溶解平衡曲线,蒸发水可使溶液由b点变到a点 | |
| D. | 图丁表示分别稀释l0mLpH均为12的NaOH和NH3•H2O溶液时pH的变化,曲线I表示NH3•H2O溶液,n>100 |
1.25℃时,1mol/L醋酸加水稀释至0.01mol/L,下列说法正确的是( )
| A. | 溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的值增大 | B. | pH增大2个单位 | ||
| C. | 溶液中c(OH-)减小 | D. | Kw减小 |
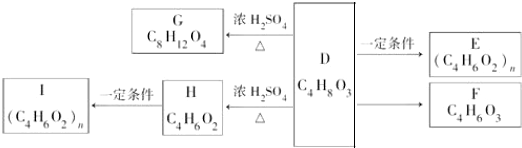
 .
. +2H2O.
+2H2O.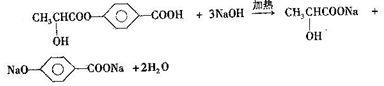 .
.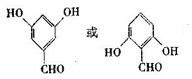 .
.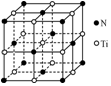 TiO2是一种性能优良的半导体光催化剂,能有效地将有机污染物(如甲醛、甲苯等)和含氮化合物(如NH3、CN-等)转化为CO2和N2等小分子物质.
TiO2是一种性能优良的半导体光催化剂,能有效地将有机污染物(如甲醛、甲苯等)和含氮化合物(如NH3、CN-等)转化为CO2和N2等小分子物质.