题目内容
18.在给定的条件下,下列选项所示的物质间转化均能实现的是( )| A. | H2SO4(浓)$\stackrel{Fe}{→}$SO2$\stackrel{BaCl_{2}(aq)}{→}$BaSO3(s) | |
| B. | NH3$→_{催化剂,△}^{O_{2}}$NO$\stackrel{H_{2}O}{→}$HNO3 | |
| C. | SiO2$→_{△}^{NaOH(AQ)}$Na2SiO3(aq)$\stackrel{足量CO_{2}}{→}$H2SiO3 | |
| D. | NaAlO2$\stackrel{盐酸}{→}$AlCl3(aq)$\stackrel{△}{→}$AlCl3(s) |
分析 A、铁与浓硫酸在加热的条件下生成二氧化硫,而盐酸的酸性强于亚硫酸;
B、一氧化氮与水不反应;
C、二氧化硅是酸性氧化物,碳酸酸性强于硅酸;
D、氯化铝溶液加热蒸干得到氢氧化铝.
解答 解:A、铁与浓硫酸在加热的条件下生成二氧化硫,而盐酸的酸性强于亚硫酸,所以二氧化硫与氯化钡不反应,故A错误;
B、一氧化氮不溶于水,也不与水不反应,故B错误;
C、二氧化硅是酸性氧化物,所以二氧化硅与氢氧化钠反应生成硅酸钠和水,由于碳酸酸性强于硅酸,则硅酸钠与二氧化碳反应生成硅酸,故C正确;
D、氯化铝溶液加热蒸干得到氢氧化铝,得不到氯化铝,故D错误;
故选C.
点评 本题考查了物质性质、物质转化的应用,主要是铁、氮、铝、硅的化合物性质的理解判断,掌握基础是解题关键,题目较简单.

练习册系列答案
相关题目
8. 汽车尾气排放的NO和CO都是有毒的气体,科学家正在研究利用催化技术将尾气中的NO和CO转变成无毒的CO2和N2,减少污染.
汽车尾气排放的NO和CO都是有毒的气体,科学家正在研究利用催化技术将尾气中的NO和CO转变成无毒的CO2和N2,减少污染.
(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.0kJ/mol
2C(s)+O2(g)=2CO(g)△H=-221.0kJ/mol
2C(s)+2O2(g)=2CO2(g)△H=-787.0kJ/mol
则尾气转化反应:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746kJ/mol.
(2)对于反应2NO(g)+2CO(g)?N2(g)+2CO2(g),为了测定在某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
①前2s内的平均反应速率 υ(CO2)=6.25×10-5mol/(L•s).
②在该温度下,反应的平衡常数K=10000.
(3)假设在恒容密闭容器中发生上述反应,下列有关说法正确的是C.
A.选用更有效的催化剂能提高尾气的转化率
B.升高反应体系的温度能提高反应速率,提高尾气的转化率
C.相同温度下,若NO和CO的起始浓度分别为1.50×10-4mol/L和2.00×10-4mol/L,平衡时N2的体积分数比原平衡体系中N2的体积分数低
D.单位时间内消耗NO的物质的量等于生成CO2的物质的量时即达平衡状态
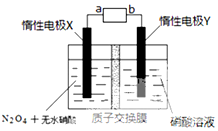
(4)用尾气NO2为原料可制新型硝化剂N2O5,原理:先将NO2转化为N2O4,再采用电解法制备N2O5,装置如图所示则电源b极是负极(填“正”“负”),生成N2O5电极反应式为N2O4+2HNO3-2e-=2N2O5+2H+,电解一段时间后硝酸溶液的pH不变(填“增大”“减小”“不变”).
 汽车尾气排放的NO和CO都是有毒的气体,科学家正在研究利用催化技术将尾气中的NO和CO转变成无毒的CO2和N2,减少污染.
汽车尾气排放的NO和CO都是有毒的气体,科学家正在研究利用催化技术将尾气中的NO和CO转变成无毒的CO2和N2,减少污染.(1)已知:N2(g)+O2(g)=2NO(g)△H=+180.0kJ/mol
2C(s)+O2(g)=2CO(g)△H=-221.0kJ/mol
2C(s)+2O2(g)=2CO2(g)△H=-787.0kJ/mol
则尾气转化反应:2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-746kJ/mol.
(2)对于反应2NO(g)+2CO(g)?N2(g)+2CO2(g),为了测定在某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/×10-4mol/L | 3.00 | 2.25 | 1.75 | 1.36 | 1.00 | 1.00 |
| c(CO)/×10-4mol/L | 4.00 | 3.25 | 2.75 | 2.36 | 2.00 | 2.00 |
①前2s内的平均反应速率 υ(CO2)=6.25×10-5mol/(L•s).
②在该温度下,反应的平衡常数K=10000.
(3)假设在恒容密闭容器中发生上述反应,下列有关说法正确的是C.
A.选用更有效的催化剂能提高尾气的转化率
B.升高反应体系的温度能提高反应速率,提高尾气的转化率
C.相同温度下,若NO和CO的起始浓度分别为1.50×10-4mol/L和2.00×10-4mol/L,平衡时N2的体积分数比原平衡体系中N2的体积分数低
D.单位时间内消耗NO的物质的量等于生成CO2的物质的量时即达平衡状态
(4)用尾气NO2为原料可制新型硝化剂N2O5,原理:先将NO2转化为N2O4,再采用电解法制备N2O5,装置如图所示则电源b极是负极(填“正”“负”),生成N2O5电极反应式为N2O4+2HNO3-2e-=2N2O5+2H+,电解一段时间后硝酸溶液的pH不变(填“增大”“减小”“不变”).
9.某小组同学设计如下实验,研究亚铁盐与H2O2溶液的反应.
【实验Ⅰ】
试剂:酸化的0.5mol•L-1FeSO4溶液(pH=0.2),5% H2O2溶液(pH=5)
(1)上述实验中H2O2溶液与FeSO4溶液反应的离子方程式是2Fe2++2H++H2O2=+2Fe3++2H2O.
(2)产生气泡的原因是Fe3+催化下H2O2分解生成O2.
【实验Ⅱ】
试剂:未酸化的0.5mol•L-1FeSO4溶液(pH=3),5% H2O2溶液(pH=5)
(3)将上述混合物分离,得到棕黄色沉淀和红褐色胶体.取部分棕黄色沉淀洗净,加4mol•L-1盐酸,沉淀溶解得到黄色溶液.初步判断该沉淀中含有Fe2O3,经检验还含有SO42-.检验棕黄色沉淀中SO42-的方法是取加入盐酸后的黄色溶液少许于试管中,加入BaCl2溶液,产生白色沉淀,说明棕黄色沉淀中含有SO42-.
(4)对于生成红褐色胶体的原因,提出两种假设:
i. H2O2溶液氧化Fe2+消耗H+
ii.Fe2+氧化的产物发生了水解
①根据实验II记录否定假设 i,理由是反应后溶液的pH降低.
②实验验证假设 ii:取Fe2(SO4)3溶液,加热,溶液变为红褐色,pH下降,证明假设 ii成立.
(5)将FeSO4溶液加入H2O2溶液后,产生红褐色胶体,反应的离子方程式是2Fe2++4H2O+H2O2=+2Fe(OH)3(胶体)+2H+.
【实验Ⅲ】
若用FeCl2溶液替代FeSO4溶液,其余操作与实验 II相同,除了产生与 II相同的现象外,还生成刺激性气味气体,该气体能使湿润的蓝色石蕊试纸变红但不褪色.
(6)产生刺激性气味气体的原因是H2O2分解反应放热,促进Fe3+的水解平衡正向移动,产生的HCl受热挥发.
(7)由实验Ⅰ、Ⅱ、Ⅲ可知,亚铁盐与H2O2反应的现象与pH、阴离子种类、温度、反应物用量(至少写两点)有关.
【实验Ⅰ】
试剂:酸化的0.5mol•L-1FeSO4溶液(pH=0.2),5% H2O2溶液(pH=5)
| 操作 | 现象 |
| 取2mL上述FeSO4溶液于试管中,加入5滴5% H2O2溶液 | 溶液立即变为棕黄色,稍后,产生气泡.测得反应后溶液pH=0.9 |
| 向反应后的溶液中加入KSCN溶液 | 溶液变红 |
(2)产生气泡的原因是Fe3+催化下H2O2分解生成O2.
【实验Ⅱ】
试剂:未酸化的0.5mol•L-1FeSO4溶液(pH=3),5% H2O2溶液(pH=5)
| 操作 | 现象 |
| 取2mL 5% H2O2溶液于试管中,加入5滴上述FeSO4溶液 | 溶液立即变为棕黄色,产生大量气泡,并放热,反应混合物颜色加深且有浑浊.测得反应后溶液pH=1.4 |
(4)对于生成红褐色胶体的原因,提出两种假设:
i. H2O2溶液氧化Fe2+消耗H+
ii.Fe2+氧化的产物发生了水解
①根据实验II记录否定假设 i,理由是反应后溶液的pH降低.
②实验验证假设 ii:取Fe2(SO4)3溶液,加热,溶液变为红褐色,pH下降,证明假设 ii成立.
(5)将FeSO4溶液加入H2O2溶液后,产生红褐色胶体,反应的离子方程式是2Fe2++4H2O+H2O2=+2Fe(OH)3(胶体)+2H+.
【实验Ⅲ】
若用FeCl2溶液替代FeSO4溶液,其余操作与实验 II相同,除了产生与 II相同的现象外,还生成刺激性气味气体,该气体能使湿润的蓝色石蕊试纸变红但不褪色.
(6)产生刺激性气味气体的原因是H2O2分解反应放热,促进Fe3+的水解平衡正向移动,产生的HCl受热挥发.
(7)由实验Ⅰ、Ⅱ、Ⅲ可知,亚铁盐与H2O2反应的现象与pH、阴离子种类、温度、反应物用量(至少写两点)有关.
6.NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 1 mol白磷中含共价键数均为4NA | |
| B. | 1 mol-CH3中含有的电子数为9 NA | |
| C. | 1 mol Na2O2 固体中含离子总数为4 NA | |
| D. | 标准状况下,2.24 L SO3所含分子数为0.1 NA |
13.仅用下表提供的实验用品(规格、数量不限),能实现相应实验目的是( )
| 选项 | 实验用品(省略夹持装置) | 相应实验 |
| A | 蒸发皿、玻璃棒、泥三角、三脚架 | 从食盐水中获得NaCl晶体 |
| B | 烧杯、玻璃棒、漏斗、滤纸 | 除去氢氧化铝胶体中的泥沙 |
| C | 烧杯、玻璃棒、胶头滴管、容量瓶 | 用胆矾配制100mL0.1mol/L的硫酸铜溶液 |
| D | 蒸馏烧瓶、温度计、冷凝管、石棉网、牛角管、锥形瓶、酒精灯 | 用四氯化碳萃取溴水中的溴 |
| A. | A | B. | B | C. | C | D. | D |
10.化学与社会、生活密切相关.对下列化学应用的判断和解释均正确的是( )
| 选项 | 化学应用 | 判断及解释 |
| A | 燃烧法可以鉴别羊毛和棉线 | 对.羊毛的主要成分是蛋白质,燃烧有烧焦羽毛气味. |
| B | 高锰酸钾可用于水果保鲜 | 错.因为高锰酸钾会氧化水果中的有机物 |
| C | SiO2可用于制备光导纤维 | 对.因为SiO2有导电性 |
| D | 误食重金属盐引起人体中毒均可以喝大量食盐水解毒 | 对.因为食盐水有解毒功能 |
| A. | A | B. | B | C. | C | D. | D |
7.下列各实验的原理、操作、现象和结论均完全正确的是( )
| A. | 证明某红棕色气体是溴蒸气还是NO2,可用AgNO3溶液检验,观察是否有沉淀生成 | |
| B. | 将点燃的镁条迅速投入到集满CO2的集气瓶中,观察到镁条在集气瓶底部继续燃烧 | |
| C. | 实验室用氢氧化钠标准溶液滴定未知浓度的醋酸溶液时,选用甲基橙做指示剂 | |
| D. | 向盛有5mL苯酚溶液的试管中滴入2~3滴稀溴水,边加边振荡,立即观察到有白色沉淀生成 |
8.下列实验设计正确的是( )
| A. | 检验淀粉已完全水解;在淀粉水解液中滴加碘水 | |
| B. | 证明氧化性H2O2比Fe3+强,将硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中 | |
| C. | 检验某溶液中含Fe2+:可先向溶液中加入氯气,再滴加少量KSCN溶液 | |
| D. | 把0.9mol•L-1硫酸100mL;将18 mol•L-1硫酸5mL移入100mL容量瓶,加水至刻度 |
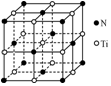 TiO2是一种性能优良的半导体光催化剂,能有效地将有机污染物(如甲醛、甲苯等)和含氮化合物(如NH3、CN-等)转化为CO2和N2等小分子物质.
TiO2是一种性能优良的半导体光催化剂,能有效地将有机污染物(如甲醛、甲苯等)和含氮化合物(如NH3、CN-等)转化为CO2和N2等小分子物质.