题目内容
为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.请回答相关问题:
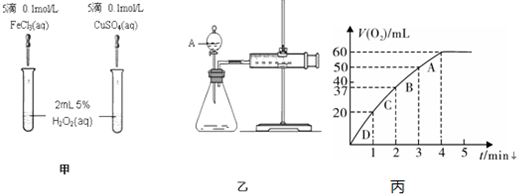
(1)定性分析:如图甲可通过观察 现象,定性比较得出结论.有同学提出将Cu SO4改为CuCl2更为合理,其理由是 .
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略.图中仪器A的名称为 ,实验中需要测量的数据是 .
(3)加入0.10mol MnO2粉末于50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图丙所示.
①A、B、C、D各点反应速率快慢的顺序为 > > > .
②解释反应速率变化的原因 .

(1)定性分析:如图甲可通过观察
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略.图中仪器A的名称为
(3)加入0.10mol MnO2粉末于50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图丙所示.
①A、B、C、D各点反应速率快慢的顺序为
②解释反应速率变化的原因
考点:浓度、温度、催化剂对化学反应速率的影响
专题:化学反应速率专题
分析:(1)比较反应速率的大小可通过生成气泡的快慢来判断,比较金属阳离子的催化效果要排斥阴离子的干扰;
(2)根据常用的仪器名称分析,该反应是通过反应速率分析的,所以根据v=
分析;
(3)①根据v=
比较反应速率快慢;
②物质的浓度与反应速率成正比.
(2)根据常用的仪器名称分析,该反应是通过反应速率分析的,所以根据v=
| △V |
| △t |
(3)①根据v=
| △V |
| △t |
②物质的浓度与反应速率成正比.
解答:
解:(1)定性比较Fe3+和Cu2+对H2O2分解的催化效果,可以通过观察产生气泡的快慢来比较,产生气泡快的,催化效果好;在探究Fe3+和Cu2+对H2O2分解的催化效果是,必须保持其他的条件相同,所以将CuSO4改为CuCl2更为合理,可以避免由于阴离子不同造成的干扰,
故答案为:单位时间内产生气泡的快慢; 消除阴离子不同对实验的干扰(控制变量的数量);
(2)A仪器是有活塞能控制滴加速率的漏斗,名称是分液漏斗,根据v=
,还需要测定产生40mL气体所需的时间,
故答案为:分液漏斗;产生40mL气体所需的时间;
(3)①根据图象结合v=
知,A、B、C、D各点反应速率快慢的顺序为D>C>B>A,
故答案为:D>C>B>A;
②反应速率与反应物浓度成正比,随着反应的进行,反应物浓度逐渐降低,反应速率逐渐减小,
故答案为:随着反应的进行,反应物浓度减小,反应速率减慢.
故答案为:单位时间内产生气泡的快慢; 消除阴离子不同对实验的干扰(控制变量的数量);
(2)A仪器是有活塞能控制滴加速率的漏斗,名称是分液漏斗,根据v=
| △V |
| △t |
故答案为:分液漏斗;产生40mL气体所需的时间;
(3)①根据图象结合v=
| △V |
| △t |
故答案为:D>C>B>A;
②反应速率与反应物浓度成正比,随着反应的进行,反应物浓度逐渐降低,反应速率逐渐减小,
故答案为:随着反应的进行,反应物浓度减小,反应速率减慢.
点评:本题考查速率与图象间的关系,题目难度中等,解答须理清气体的体积和反应速率的关系.注意催化剂对反应速率的影响.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列各组物质互为同分异构体的是( )
| A、CH4与CH3CH3 | ||||
| B、正丁烷与异丁烷 | ||||
| C、O2与O3 | ||||
D、
|
下列有关物质的性质或应用的说法中正确的是( )
| A、浓硫酸具有吸水性,可用作干燥剂 |
| B、浓硝酸与铁不反应,可用铁桶贮存浓硝酸 |
| C、硅可作半导体材料,是光导纤维的主要成分 |
| D、SO2能使含有酚酞的NaOH溶液褪色,说明SO2具有漂白性 |
下列判断正确的是( )
| A、等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量多 |
| B、C、Si和Ge的最外层电子数都是4,次外层电子数都是8 |
| C、若A2+2D-=2A-+D2,则氧化性:A2>D2 |
| D、CO2和SiO2都是酸性氧化物,都不能和氧化钙反应 |
配制0.1mol/L的NaOH溶液,下列操作会使实验结果偏低的是( )
| A、用滤纸称量NaOH固体 |
| B、移液前容量瓶内有水珠 |
| C、摇匀后,液面低于刻度线,再加水至刻度线 |
| D、定容时,俯视刻度线 |