题目内容
氧化镁和氧化铁的固体混合物24g中含0.5mol O.求其中氧化镁的物质的量.
考点:物质的量的相关计算,有关混合物反应的计算
专题:计算题
分析:MgO、Fe2O3混合物的质量为24g、O原子的物质的量为0.5mol,根据固体质量、O原子的物质的量列方程式计算.
解答:
解:设MgO、Fe2O3的物质的量分别为xmol、ymol,根据其质量、O原子物质的量得,
解得
,
所以MgO、Fe2O3的物质的量分别为0.2mol、0.1mol,
答:其中氧化镁的物质的量为0.2mol.
|
解得
|
所以MgO、Fe2O3的物质的量分别为0.2mol、0.1mol,
答:其中氧化镁的物质的量为0.2mol.
点评:本题考查物质的量的有关计算,知道物质的量公式中各个物理量的关系,熟练掌握并灵活运用,题目难度不大.

练习册系列答案
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
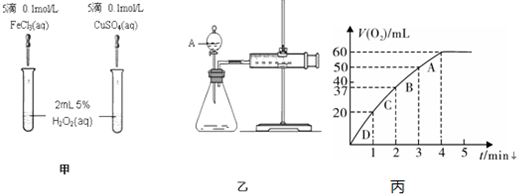
下列图示与对应的叙述相符的是( )
A、 可以表示对某化学平衡体系改变温度后反应速率的变化 |
B、 可以表示乙酸溶液中通人氨气至过量过程中溶液导电性的变化 |
C、 可以表示向明矾溶液中滴加氢氧化钠溶液产生沉淀量的变化 |
D、 可以表示足量锌粉与稀硫酸反应时加少量CuSO4产生H2的变化 |
设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A、42.0 g乙烯和丙烯的混合气体中含有的碳原子数为3NA |
| B、常温常压下,17g甲基(-14CH3)所含的中子数为9NA |
| C、标准状况下,11.2L苯中含有的碳碳双键数为1.5NA |
| D、1mol氯气与氢氧化钙溶液完全反应生成氯化钙和氯酸钙,转移的电子数为6NA |